이산화염소수를 적용한 악취가스 흡수연구
Abstract
In order to alleviate gas odors such as ammonia (NH3) and hydrogen sulfide (H2S) from the fertilization process of livestock manure, aqueous chlorine dioxide (ClO2) was added to the absorption solution in a microbubble scrubber. Microbubbles improved the absorption capacity for ammonia and hydrogen sulfide by 104% and 265%, respectively, compared to macrobubbles. Addition of ClO2 particularly increased the absorption of H2S by 530%. The mass transfer coefficient for these gases to aqueous scrubbing solution increased linearly with the flow velocity, and increased exponentially with the gas concentration.
Keywords:
Gas absorption, Odor, Microbubble, Chlorine dioxide, Mass transfer1. 서 론
다양한 발생원으로부터 배출되는 악취는 환경부 법령에 따라 암모니아, 메틸메르캅탄, 황화수소 등 22개 항목이 지정악취물질로 관리되고 있다. 특히 가축 관련시설로부터 발생되는 암모니아와 황화수소는 메스껍고 자극적인 냄새로 많은 민원의 원인이 되고 있다. 국내의 암모니아 발생량은 2017년 308,298톤/년으로 꾸준한 증가 추세를 보이고 있으며, 황화수소의 경우 보통 사료, 가축분뇨, 오니 등의 잔재물들이 쌓인 장소에서 혐기성 소화현상으로부터 발생하여 2018년 전국의 사업장에서 발생하는 황화수소 발생량은 연간 24,165톤/년이 배출되고 있다고 보고되고 있다 (ME, 2020).
2004년 농림수산식품부와 환경부가 합동으로 ‘가축분뇨 관리·이용 대책’을 수립하면서 가축분뇨의 퇴비·액비 자원화 처리의 계기를 마련하였고, 2006년 가축분뇨를 퇴비·액비로 자원화하여 농경지에 환원하는 자연 순환 개념을 접목한 ‘가축분뇨를 활용한 자연순환농업 대책’을 발표하였으며, 가동중인 가축분뇨 자원화시설 운영능력 미흡 및 관리 소홀 등으로 주변의 악취발생 등 가축분뇨 자원화처리의 문제점을 해결하고자 2007년부터 가축분뇨 자원화시설 지원사업을 추진해오고 있다. 2006년 ‘런던협약 72’ 발효에 따라 2012년부터 가축분뇨 해양배출이 중단되었고, 해양배출 물량의 육상처리를 위하여 2017년까지 자원화시설을 88개소에서 150개소로 확대 설치하는 방안을 발표한 바 있다 (Kim, 2015). 현재 운영 중인 가축분뇨 자원화시설에 악취저감시설을 설치하여 악취 발생을 최소화하는 노력을 하고 있음에도 불구하고 일부 시설에서 악취가 문제됨에 따라, 설치 예정지역에서도 악취로 인한 우려 때문에 지역 주민들이 자원화시설 설치를 반대하는 사례가 빈번하게 발생하고 있다 (Ko et al., 2006).
암모니아를 비롯한 친수성의 극성을 가지는 성분은 물에 의한 세정으로 제거할 수 있다. 습식 세정 방식은 저렴한 설비비와 간단한 조작의 장점이 있으나 다량의 물을 필요로 하는 단점과 중성이나 비극성 성분의 제거에는 적합하지 않고, 수온 변화에 따라 탈취 효과의 변동이 심하고 압력손실이 크게 발생하므로 운영비용이 높다. 또한, 세정탑 배출수에 포함된 악취 성분이 농업, 수산업에 바람직하지 않은 영향을 미치거나, 흡수 용해되어 있던 냄새 성분이 다시 방출되는 경우가 있는 단점이 있다. 이러한 미흡한 효율을 보완하기 위한 약액 세정법은 물리적인 흡수법과 약품의 화학반응을 이용하여 악취와 유해가스를 제거하는 가장 보편화된 방법이다 (Lee et al., 2017). 우선 물리적으로 가스의 흡수량을 높이기 위한 가장 우수한 기술은 50 µm 이하의 미세한 기포를 응용하는 방법이다. 미세기포는 부력이 적기 때문에 흡수탑 내부에서 천천히 부상한다. 기포가 작으면 작을수록 부력에 대한 저항효과가 증가하여 오랫동안 물속에 머무를 수 있고, 미세기포 속의 가스상 오염물질은 주변의 물 속으로 녹아 들어가게 되는데, 기포가 작을수록 비표면적이 크기 때문에 물질전달량은 증가하게된다 (Yao et al., 2016; Cha, 2009).
한편, 약액세정으로 알려진 화학흡수방법에서 이산화염소는 산화제로 작용하여 산소를 다양한 기질에 전달하면서 산화저감 (Redox)을 통해 한 개 이상의 전자를 얻을 수 있다. 동시에 물에서 가수분해되지 않고, 용해되는 용해성 가스로 취급된다. 표백제나 소독제로 많이 사용되고 있는 이산화염소는 고농도 악취처리에도 종종 적용되고 있다 (Song et al., 2011).
따라서 본 연구에서는 악취성 배출가스를 미세기포 형태로 세정탑에 공급하고, 세정액에 저농도의 이산화염소수를 혼합시킴으로써 암모니아와 황화수소를 동시에 저감할 수 있는 공정을 구성하였다. 이러한 구성에서 가스흡수능을 파악함으로써 암모니아와 황화수소 같은 현장 악취성 가스의 물리화학적 처리능력을 향상시키는 데 기여하고자 하였다.
2. 실험 방법
2. 1 시약제조
본 연구에서 사용한 이산화염소수는 차아염소산나트륨과 무기산인 염산을 반응시켜, 염소를 생성시키지 않으면서 이산화염소 수용액을 제조하는 방법을 이용하였다. 제조 시약의 농도는 9% 염산과 7.5% 아염소산나트륨 용액을 1 : 1로 혼합시켜 이산화염소 수용액을 제조하였다. 제조한 이산화염소 (ClO2)의 농도는 약 5,000 ppm±500 ppm 정도이며, 보관이나 운송 중에 빛에 의해 해리되거나 대기중으로 확산되기 때문에 실험에 필요한 적정한 양만 제조하여 실험에 사용하였다.
제조한 이산화염소수의 농도는 가스의 흡수파장을 기반으로 하는 UV 흡광광도기 (rectangular quartz cell 10 mm, OPTIZEN 2120UV, US)를 사용하여 측정하였다. 이때, 흡광도와 농도 간의 검량선을 도출해낸 후, 몰흡광계수 (L/Mol.cm)를 산정하여 기존 문헌에서 나타나는 값들과 비교하여 정량적으로 평가하였다 (Philippi et al., 2007; Chen, 1967). 다만 ClO3-는 pH가 0.1에서 표준시료를 제조하기 때문에 오차범위가 크고, 염소종으로서 농도 비율이 매우 적기 때문에 ClO2, ClO2-, HClO, ClO-에 대해서만 검량하여 농도를 지정하였다.
2. 2 실험장치 및 방법
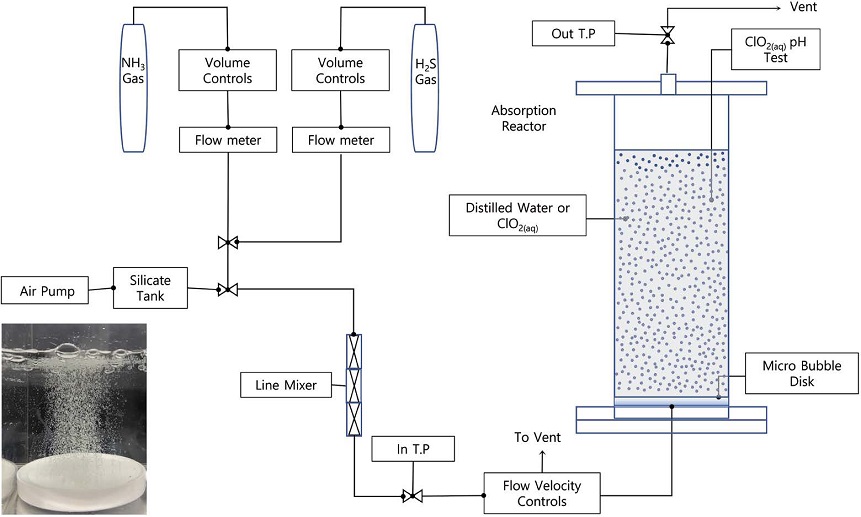
본 연구에서 사용한 실험장치는 그림 1과 같으며, 흡수반응기는 1,500 mL 용량의 투명한 glass tube에 증류수 또는 흡수용액을 500 mL 채워서 흡수층을 구성하였다. 기포 발생장치는 1 mm 이하의 기포를 발생시킬 수 있는 bubble disk와 10~80 μm 크기의 기포를 발생하는 micro-bubble disk를 사용하여 bubble valve를 거쳐 반응기 내부로 공급될 수 있도록 구성하였다.
실험인자는 가스농도, 가스유량 (유속), 암모니아와 황화수소의 주입비율로 설정하였다. 실험농도는 실제 가축분뇨 자원화시설에서 빈번하게 발생하는 값으로서, 고농도 제조가스인 암모니아와 황화수소를 고순도 건조공기로 희석하여 각각 100~400 ppm과 5~100 ppm의 범위로 공급하였다. 흡수반응 전후의 가스농도는 전기화학센서가 장착된 기기 (Tiger 2000, Ion Science Ltd., UK)를 이용하여 실시간으로 측정하였다. 암모니아와 황화수소를 동시에 처리하는 실험에서는 ppm 단위의 농도를 기준으로 400 : 40, 400 : 10, 200 : 20, 100 : 10의 비율로 line mixer에서 충분히 혼합시킨 후, 반응기로 주입하였다. 가스유량은 100, 200, 300, 400 mL/min의 범위로 변화시켜가며 흡수반응을 수행하였다.
시험제조한 산화제인 이산화염소는 세정액 내에 5~100 mg/L까지 투입해가며, 악취가스의 제거효율을 관찰하였고, 동시에 수용액의 pH 변화를 실시간으로 측정하였다. 암모니아와 황화수소가 이산화염소와 반응한 후, 형성되는 염의 화학종을 고찰하기 위해 흡수액을 105~110°C에서 48 hr 동안 건조하여 입자상 염을 회수하였고, X-Ray Diffraction (XRD; D8 ADVANCE, Germany) 법으로 화학결정상을 분석하였다.
3. 연구 결과 및 고찰
3. 1 가스기포 형성에 의한 흡수량 변화
가스기포가 형성되는 흡수반응기에서의 기-액 물질전달은 일반적으로 기포 크기, 가스 유속 (유량), 가스 농도, 흡수액, pH, 온도, 압력 등의 영향을 받는다. 본 연구에서는 실제 운전성능 지표에 직접적으로 영향을 줄 수 있는 기포 크기와 가스의 유입속도, 가스 유입농도를 실험변수로 정하였다. 수용액의 pH는 특별히 제어하지 않은 채, 반응이 진행되면서 변화되는 상태를 유지하고, 온도는 실온 (약 20°C), 압력은 대기압 (1 atm) 조건에서 실험을 진행하였다.
기포를 형성시키며 주입하는 가스의 흡수효율을 관찰하기 위하여 두 가지 사양의 다공판을 사용하였는데, bubble disk에 의해 형성되는 기포는 대체로 1 mm 이하를 보여주어 본 연구에서는 ‘거대기포’라고 명명하였고, micro-disk를 통하여 발생되는 80 μm 이하의 기포를 ‘미세기포’로서 정의하였다 (※그림 1 내부 사진 참조). 본 연구에서는 미세기포와 거대기포를 초고속 카메라로 촬영하여 일정구간의 평균 상승속도를 측정함으로써 각각의 기포 크기를 산출하였다. 그 결과, 미세기포는 평균 73 μm였으며, 거대기포는 772 μm로 나타났다.
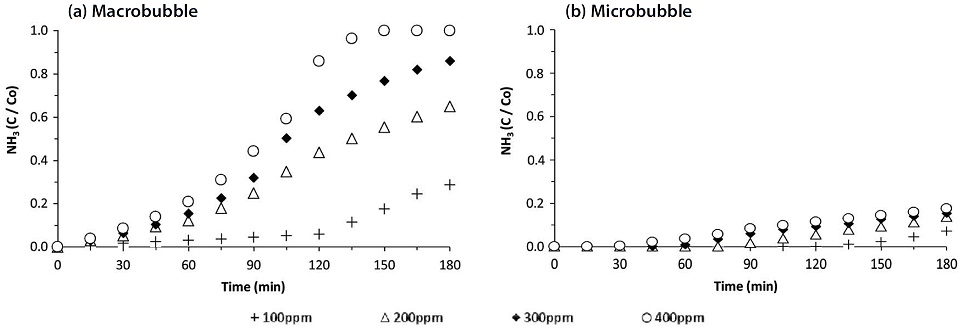
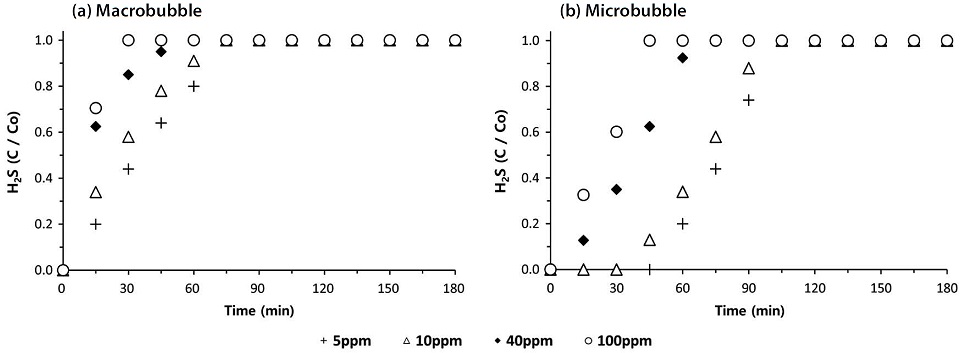
그림 2와 3은 암모니아와 황화수소에 대한 거대기포와 미세기포의 흡수특성을 각각 비교한 결과이다. 가스상 악취를 거대기포 형태로 400 mL/min의 유량으로 주입 시 400 ppm의 암모니아의 경우 (a), 150분 만에 유입농도와 유출농도가 동일해지는 파과점에 도달하지만, 미세기포 (b)를 적용하면 거대기포의 파과점 이후에도 계속 흡수가 진행되어 960분 만에 파과점에 도달하였다. 이는 거대기포에 비해 미세기포가 현저하게 흡수효율이 높다는 것을 의미하고, 파과시간을 6.74배 지연시켰음을 알 수 있다. 파과점에 이르기까지 흡수한 암모니아의 양은 400 ppm의 농도에서 9.77 mg으로부터 19.99 mg까지 104% 증가하였다. 또한 100 ppm 황화수소의 경우, 0.26 mg에서 0.95 mg 까지 265% 증가하였고, 파과시간도 50% 이상 지연되는 것을 알 수 있다. 이러한 흡수량은 물에 대한 이론적인 용해도에 비해 현저하게 적은 수준이지만, 미세기포의 특징상, 가스 상승속도를 낮추어 체류시간을 증가시키고, 기·액간 접촉면적을 향상시킴으로써 흡수량을 증가시키는 결과를 얻게되었다 (Kantarci et al., 2005).
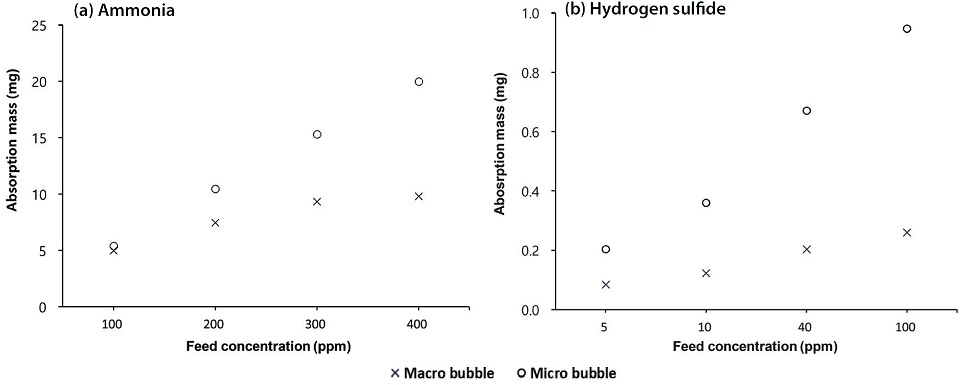
유입가스의 농도에 따른 파과시간은 흡수되는 절대량에 따라 농도가 낮을수록 지연되는 현상이 자연스럽게 나타났다. 그림 4에 요약한 결과를 보면, 흡수량도 100 ppm 암모니아의 경우, 거대기포에서 4.97 mg이었는데, 미세기포 형태로 공급하면서 5.4 mg으로 약간 증가하였다. 5 ppm의 저농도 황화수소는 0.08 mg (거대기포)에서 0.2 mg (미세기포)까지 증가할 수 있었다. 유입농도가 증가함에 따라 흡수되는 악취가스의 절대량도 비례적으로 증가하지만, 그 경향은 미세기포의 형태로 가스가 유입될 때, 물리적인 물질전달량이 크기 때문에 훨씬 명확하게 나타났다 (Terasaka, 2010).
한편, 가축분뇨 자원화시설에서는 암모니아와 황화수소가 동시에 발생하는 주요 악취성 가스이기 때문에 두 가지 가스를 동시에 주입하였을 때, 각각의 가스별로 흡수되는 상대적인 양을 고찰해보았다. 암모니아와 황화수소를 농도기준으로 400 : 40 ppm, 400 : 10 ppm, 200 : 20 ppm, 100 : 10 ppm 비율로 거대기포와 미세기포 상태로 각각 주입하였다. 그림 5와 6을 살펴보면, 180 min의 반응시간 동안 가스의 유량이 증가함에 따라 흡수량은 꾸준히 증가함을 알 수 있다. 유속증가는 반응기 내에서의 난류를 강화시키기 때문에 일정한 수준까지는 지속적으로 흡수량 증가를 유도할 것으로 판단된다. 또한 그림 4의 400 ppm ((a), (b))과 200 ppm ((c), (d))의 암모니아에서 볼 수 있듯이 가스의 주입량이 혼합가스의 비율보다 흡수량에 직접적인 영향을 주고 있다.
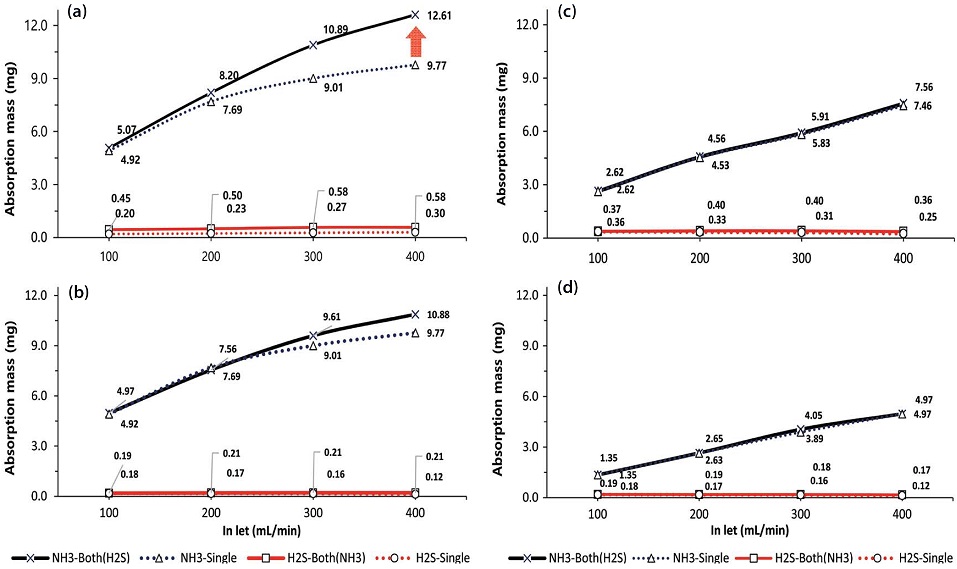
Absorption amount of mixed gas at the ratio of (a) 400 : 40 ppm, (b) 400 : 10 ppm, (c) 200 : 20 ppm, (d) 100 : 10 ppm NH3 and H2S in D.W with macro bubbles (180 min).
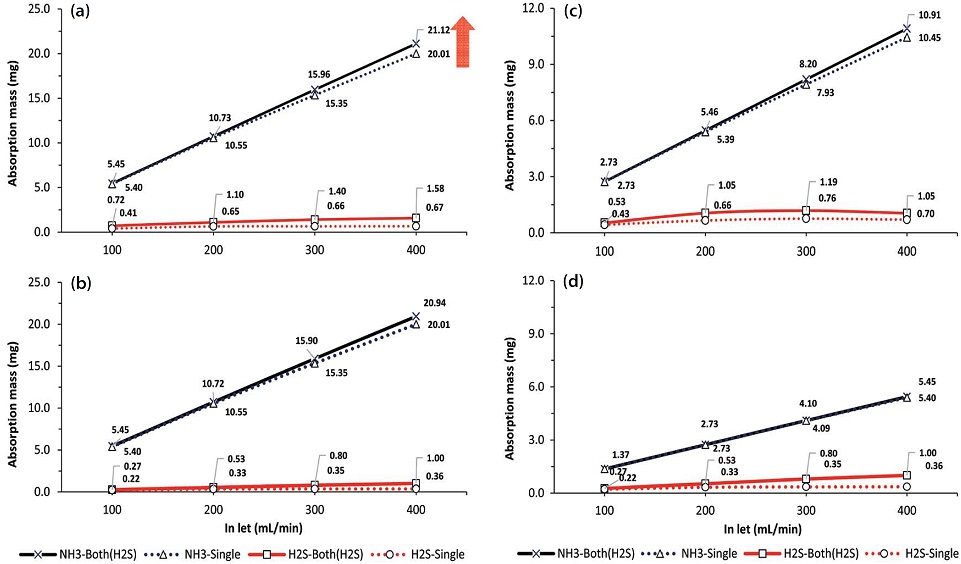
Absorption amount of mixed gas at the ratio of (a) 400 : 40 ppm, (b) 400 : 10 ppm, (c) 200 : 20 ppm, (d) 100 : 10 ppm NH3 and H2S in D.W with micro bubbles (180 min).
시험대상 가스를 개별적 (single)으로 유입시켰을 때보다, 혼합형태 (mixed)로 주입하였을 때, 흡수량은 약간 더 증가하였다. 이러한 결과는 습식세정 공정에서 암모니아와 황화수소를 동시에 주입할 때, 상호간의 완충반응으로 가스의 흡수성능을 오히려 향상시킨다는 연구 결과와 일치한다 (Cho et al., 2018; Park and Kim, 2011). 가장 분명한 차이는 400 ppm의 암모니아와 40 ppm의 황화수소가 동시에 400 mL/min의 유량으로 세정반응기 내로 유입될 때 (a), 흡수량 차이가 가장 크게 나타났고, 동일한 상대적인 비율 (10 : 1)이지만 절대량이 적은 (c)의 경우는 단일가스와 혼합가스에 대한 차이가 거의 보이지 않았다.
이러한 가스성분비의 차이는 흡수량이 확연히 증가하였던 미세기포 형태의 유입 시, 더욱 감소하였다. 즉, 그림 6의 (a)를 그림 5의 (a)와 비교해보면 이 같은 경향을 확인할 수 있다. 그러나 황화수소는 오히려 혼합가스 형태로 주입될 때 더 많은 양이 흡수되고 있음을 보여주었다. 혼합가스가 미세기포 형태로 유입되면서 암모니아가 빠르게 물에 흡수되어 pH를 증가시키므로 용해도가 상대적으로 낮은 황화수소가 흡수되기 쉬운 환경이 조성되는 것으로 사료된다. 반응 시작 180 min 후, 용액의 pH는 미세기포의 형태로 혼합가스 (400 ppm : 40 ppm)가 주입되면 11.16까지 상승하지만, 거대기포에서는 10.81이 최대치였다. 따라서 가스의 흡수량은 용액의 pH와 밀접한 관계를 가질 수 밖에 없는 것으로 판단된다. 실제로 악취배출 현장에서는 적정량의 수소이온을 확보하기 위하여 세정탑의 흡수액에 황산을 소량 첨가하는 것으로 알려져있다.
3. 2 이산화염소수 첨가에 따른 흡수량 변화
미세기포의 효용성에 더하여 흡수액에 산화·환원 적용이 가능한 이산화염소수를 첨가함으로써 암모니아와 황화수소의 흡수효율을 향상시키고자 하였다. 그림 7은 흡수액에 대한 이산화염소의 농도를 5 mg/L에서 100 mg/L까지 변화시켜가며 가스 흡수량을 비교한 그래프이다. 이산화염소의 첨가는 황화수소 (b)에서 분명한 차이를 보여주고 있다. 특히 100 ppm의 황화수소가 공급되는 경우, 흡수액 중 이산화염소의 농도에 대한 효과가 매우 분명하게 나타나는 것을 알 수 있다. 반면에 암모니아 흡수에 대한 이산화염소의 영향은 매우 낮았다. 즉, 100 ppm의 암모니아 흐름에서 이산화염소수는 농도에 관계없이 거의 일정한 흡수량 (5.4~5.46 mg)을 보여주었고, 이러한 경향은 가장 높은 시험농도인 400 ppm에 대해서도 발견되었다 (19.99~21.78 mg). 암모니아는 물에 대한 용해도가 매우 크기 때문에 소량의 산성용기를 가진 이산화염소가 산-염기 상호인력을 촉진시킴으로써 화학적인 흡수효과를 나타내기에는 상대적으로 미미한 바, 물 속에서의 물리적인 용해효과가 더 지배적인 것으로 판단된다.
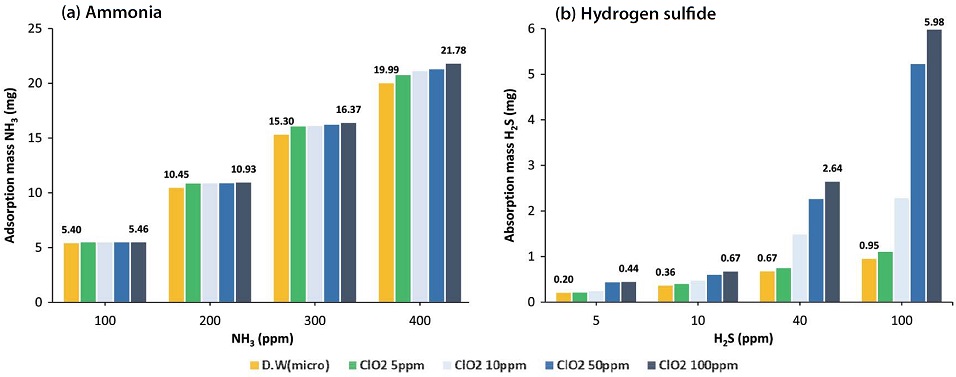
Absorption mass in terms of gas feed concentration and ClO2 concentration with microbubbles (400 mL/min, 180 min).
이산화염소가 낮은 농도 (5 ppm)로 존재할 때는 두 가지 가스에 대해 모두 일반 증류수와 차이가 크지 않은 것으로 미루어 보아 이산화염소수의 농도가 높을수록 가스 흡수능력을 향상시키는 것으로 보인다.
이산화염소가 100 mg/L 포함된 흡수액의 pH는 5.64였지만, 40 ppm의 황화수소를 180 min 동안 처리하고난 후의 흡수액은 pH가 3.46까지 낮아졌다. 이는 증류수를 흡수액으로 적용했을 때 나타났던 pH 3.89보다 낮은 수치이다. 또, 암모니아와 황화수소가 400 ppm과 40 ppm으로 함께 미세기포 형태로 공급되었을 때, 증류수에서는 pH가 8.93까지 상승하였으나 이산화염소수 (100 mg/L)에서는 최대 7.29까지 밖에 상승하지 않은 것으로 나타났다. 이를 통해서도 황화수소의 분명한 흡수량 증가를 유추해 볼 수 있다. 가장 높은 황화수소 시험농도인 100 ppm에서 증류수보다 이산화염소수 (100 mg/L) 흡수액일 경우 10.95 mg에서 5.98 mg으로 증가하였음을 보여주었다.
한편, 암모니아와 황화수소 가스를 동시에 주입시켰을 때에도 기존의 증류수를 사용했을 때와 유사한 경향을 보였으나 황화수소의 경우, 1.54 mg/L 정도 더 흡수됨으로써 뚜렷한 상승작용을 보여주었다.
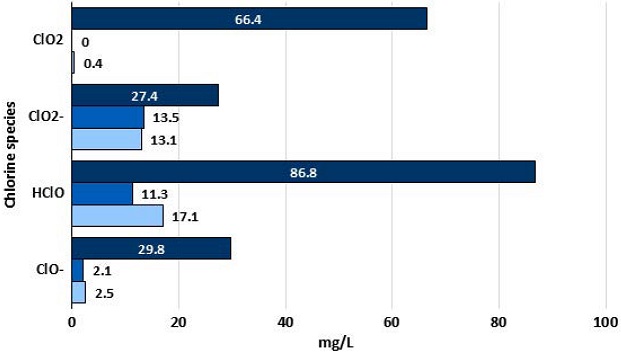
본 연구에서 준비한 이산화염소 100 mg이 포함된 세정액 1 L에는 ClO2, ClO2-, HClO, ClO-가 각각 66.4, 27.4, 86.8, 29.8 mg/L 존재하는 것으로 분석되었다. 즉, 순수 이산화염소 외에도 초기 제조한 이산화염소수에는 기타 염소종이 존재하고 있는 것으로 짐작된다. 수중으로부터 이들이 자연적으로 소멸되는 양을 관찰하기 위하여 400 mL/min의 유량 고순도 공기를 미세기포 형태로 공급해보았다. 공급하기 시작한 후, 120 min이 경과하자, pH는 5.64에서 시작하여 6.01로 선형적으로 상승하였으며, ClO2와 ClO-는 거의 소멸하여 존재하지 않았으나 ClO2-와 HClO는 최종적으로 각각 27.4 및 31.6 mg/L씩 잔재하였다. 즉, ClO2와 ClO-는 공기기포와 함께 증발하였지만 ClO2-와 HClO는 보다 더 안정된 상태로 물에 용해되어 있는 것으로 추측된다.
그림 8은 제조한 이산화염소 100 mg/L이 포함된 세정액에 a)암모니아 100 ppm과 b)황화수소 40 ppm을 미세기포 형태로 각각 주입했을 때, 이산화염소 종들의 농도 변화를 나타낸 결과이다. 또한 두 가지 가스를 동시에 주입하였을 때는 염소종이 남아있지 않았으므로 결과를 그래프에서 제외하였다.
고찰 결과, 암모니아를 주입했을 경우, 반응 후에 흡수액에는 ClO2 0 mg/L, ClO2- 13.5 mg/L, HClO 11.3 mg/L, ClO- 2.1 mg/L가 남아있었고, 이때 최종 pH는 5.64에서 6.54로 상승하였다. 황화수소의 경우, ClO2 0.4 mg/L, ClO2- 13.1 mg/L, HClO 17.1 mg/L, ClO- 2.5 mg/L가 흡수액에 잔재하였다. 이때 pH는 3.92로 관찰되었다. 이는 이산화염소 흡수액에서 공기기포만을 공급했을 경우와 다른 결과 값으로서 이산화염소종들이 순수공기를 공급했을 때보다 더 많이 감소되었으며, 특히 ClO2와 HClO가 현저히 감소되었음을 보여주었다.
세정액에 첨가된 이산화염소수에 의한 암모니아와 황화수소의 산화·환원 반응으로부터 다양한 결정상의 염이 생성될 것으로 예상되어 고농도의 가스를 공급하여 흡수 반응을 진행시킨 후, 침전되는 염을 회수하여 분석해보았다. 먼저 암모니아 가스와의 반응 부산물을 확인하기 위하여 500 mg/L의 이산화염소가 포함되어 있는 흡수액 500 mL에 1000 ppm의 암모니아가스를 미세기포 형태로 500 mL/min의 유량으로 240 min 동안 반응시킨 후, 미량의 침전물과 부유상태의 현탁물질을 105~110°C의 진공오븐에서 24 hr 동안 건조시켜 채취하였다.
그림 9는 암모니아와 황화수소 가스를 흡수한 후 얻어지는 침전물에 대한 XRD 분석 결과이다. 암모니아의 경우 염화암모늄 (NH4Cl, Ammonium chloride) 결정이 대부분의 주 피크를 구성하고 있었으며, 황화수소의 경우 S8 (Sublimed sulfur)가 가장 높은 강도를 나타냈다.
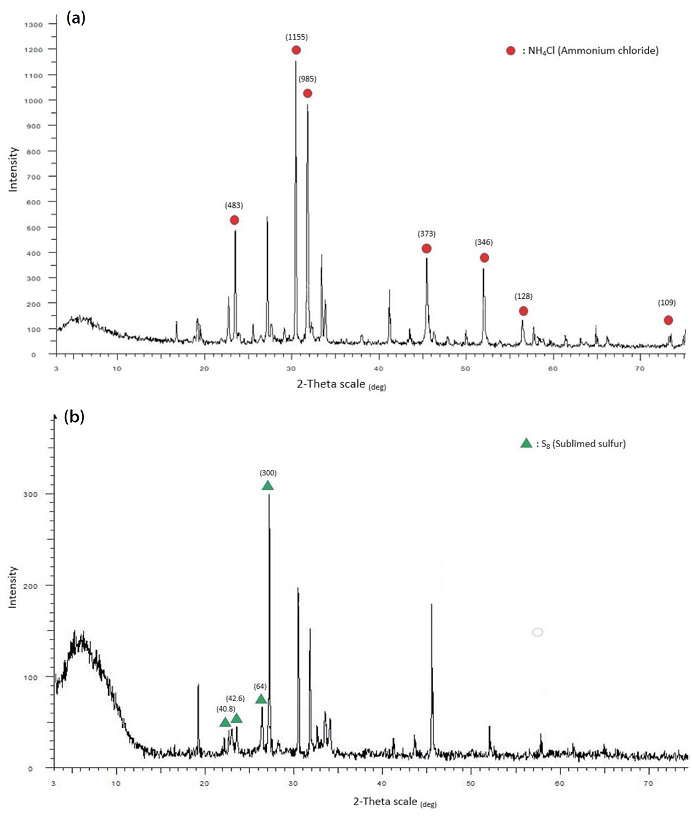
XRD deffractograms of precipitated salts from absorption of NH3 (1000 ppm) and H2S (100 ppm) by ClO2 solution.
수용액 중에서 암모니아가 암모늄염으로 전환되는 메카니즘에 비하여 황화수소는 훨씬 다양한 경로를 통하여 여러 가지 부산물을 합성하는데, 본 흡수액과 같이 pH 12 이하인 수용액으로 유입되면 아래 반응식 (1)과 같이 H+와 HS- 형태로 해리된다 (Kang et al., 2019). 따라서 흡수액의 pH는 다시 감소하고, 다양한 염소종들과 반응하면서 부산물로서 고체염 형태의 황 (S)을 형성하는 것으로 추정된다 (반응식 (2)).
| (1) |
| (2) |
이렇게 흡수액에 암모니아와 황화수소가 이온상으로 존재하지 않고, 염으로 고정되어 있으면 배출되는 악취가스가 흡수된 후, 재방출되지 않고 세정탑에 남아 있으므로 궁극적으로 전체 포집효율을 향상시키는 결과를 얻을 수 있다.
3. 3 이산화염소수에 의한 악취가스의 흡수메카니즘 고찰
기체상의 악취성 가스인 암모니아와 황화수소가 증류수 및 이산화염소가 함유된 흡수액으로 유입되면서 발생하는 물질전달 특성을 고찰해보았다. 기-액 계면에서 발생하는 물질전달에 관한 일반적인 정의는 다음의 식 (3)과 같다. 본 연구에서는 암모니아와 황화수소가 이산화염소가 존재하는 흡수액상으로 유입되면서 발생하는 각각의 물질전달계수 (kLa)를 비교해봄으로써 이산화염소의 효용성을 상대적으로 평가해보고자 하였다.
| (3) |
여기서 dNA/dt는 180 min 동안에 흡수된 가스의 몰 수로부터 계산하고, CA*는 헨리상수를 고려한 가스의 액상에서의 평형농도, CA는 반응종료 후, 흡수액에 잔존하는 가스상 오염물질농도이다.
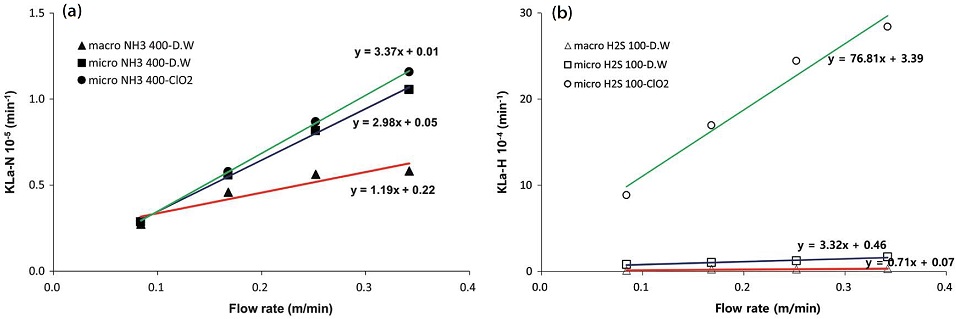
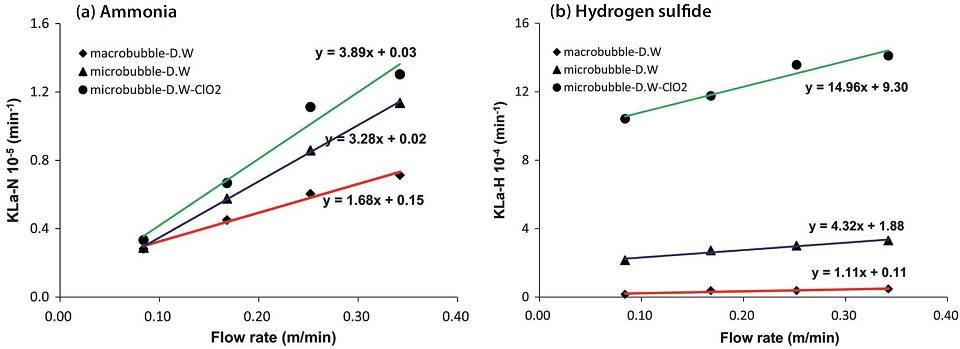
그림 10을 보면 본 연구의 실험범위 내에서 두 가지 가스 모두 유입유량 대비 물질전달계수는 선형적으로 비례하는 관계를 보여주고 있다. 황화수소의 경우, 이산화염소수에 미세기포 형태로 유입될 때 물질전달계수가 급격히 증가하였는데, 이는 앞서 살펴본 바와 같이 황화수소가 암모니아보다 이산화염소 종들과 더 다양한 반응에 참여하기 때문인 것으로 사료된다. 수용액에서의 용해도가 큰 암모니아는 평형농도값이 매우 높기 때문에 가스의 공급유량이 증가함에 따라 물 속으로 확산되는 양 또한 크게 증가하고 있고, 황화수소는 미세기포 형태로 공급될 때, 수중에 반응성 높은 화학종이 존재함으로써 분자의 해리를 촉진시키는 것으로 판단된다.
흡수액을 순수 증류수로만 구성하였을 때, 거대기포와 함께 유입되는 암모니아 가스의 유량에 따른 물질전달계수의 증가율은 1.19×10-5 m-1이었고, 미세기포에서는 약 1.5배 증가한 1.98×10-5 m-1을 보여주고 있다. 그러나 이산화염소수를 첨가했을 때는 약간 더 증가하여 3.37×10-5 m-1가 되었다. 반면에 황화수소는 이산화염소수에서 유량의 증가량 대비 물질전달계수의 증가율이 가파르게 상승하고 있음을 알 수 있다.
한편, 두 가지 가스를 동시에 주입하여 흡수반응을 유도하였을 때, 그림 11에서 보듯이 암모니아의 유량에 따른 물질전달계수의 증가 형태는 개별가스가 주입되었을 때와 유사하지만, 황화수소는 계수의 절대값뿐만 아니라 증가율도 완만한 증가추세를 보여주었다.
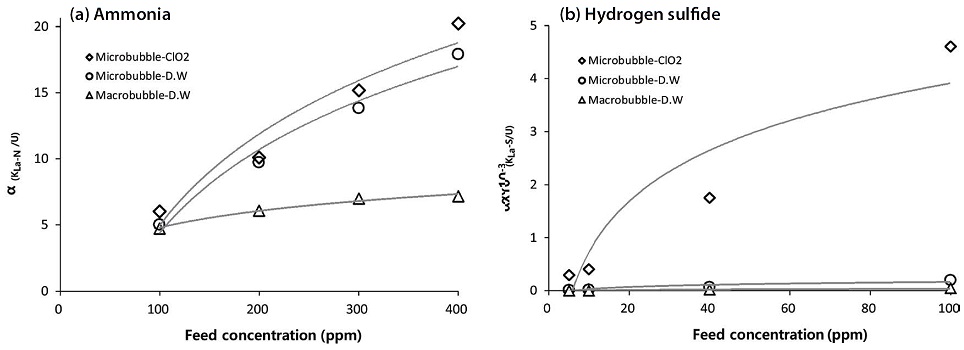
두 가지 가스의 물질전달계수를 각 가스의 유입농도에 따라 고찰하여 그림 12에 요약하였다. 물질전달계수는 가스의 농도가 증가할수록 함께 증가하는 추세를 보여주고, 결국 미세기포와 이산화염소수로 구성한 반응기가 흡수율이 높아지는 것으로 결론지을 수 있다. 다만, 농도 대비 지수적인 함수관계를 보여줌에 따라 일정농도 이상에서는 흡수율이 일정하게 유지될 것으로 예상된다.
4. 결 론
가축분뇨 퇴비화 공정에서 발생하는 주요 악취물질인 암모니아와 황화수소를 습식세정법으로 동시에 처리하기 위하여 흡수액에 이산화염소수를 첨가하고, 악취가스를 미세기포 형태로 주입하는 방법을 고찰해보았다. 우선 미세기포는 증류수를 흡수액으로 선택하였을 때, 거대기포 형태에 비하여 암모니아와 황화수소의 흡수량을 각각 104%와 265%까지 증가시킬 수 있었다. 이산화염소수를 흡수액으로 사용하면, 황화수소의 경우 최대 530%까지 흡수량을 향상시킬 수 있는 것으로 나타났다. 특히 두 가지 가스가 동시에 유입될 때는 암모니아 용해에 의한 pH 증가로부터 황화수소의 흡수량이 효과적으로 증가하는 것을 발견하였다. 각 가스상 악취의 물질전달계수는 유입되는 유속에 선형적으로 비례하고 있었으며, 가스의 농도에 따라 지수적으로 증가하는 것으로 관찰되었는 바, 흡수액의 농도 대비 적정한 처리량이 존재하는 것으로 추정되었다.
이상의 실험적인 결과로 비추어볼 때, 암모니아와 황화수소가 10 : 1의 비율로 혼합되어 있을 때, 100 mg/L의 이산화염소가 함유된 흡수액을 적용하면 가장 높은 제거효율을 얻을 수 있는 것으로 판단되었다.
Acknowledgments
이 논문은 2021년도 정부 (과학기술정보통신부)의 재원으로 한국연구재단 기후변화대응기술개발사업의 지원을 받아 수행된 연구임 (2017M1A2A2086819).
References
- Cha, H.S. (2009) Present State and Future Prospect for Microbubble Technology, Bulletin of Food Technology, 22(3), 544-552.
-
Chen, T. (1967) Spectrophotometric determination of microquan tities of chlorate, chlorite, hypochlorite, and chloride in perchlorate, Analytical Chemistry, 39, 804-813.
[https://doi.org/10.1021/ac60251a023]

- Cho, J., Kang, J.H., Song, J.H. (2018) Effects of Influent Concentrations on Mass Transfer Coefficients for the Removal of Hydrogen Sulfide and Ammonia in Biogas using a Wet Scrubber, Proceedings of the 2018 Spring Conference of the Korea Society of Waste Management, 158
-
Kang, J.H., Cho, J.P., Song, J.H. (2019) Prediction of mass transfer coefficient in an absorption process for the simultaneous removal of hydrogen sulfide and ammonia, Journal of Odor and Indoor Environment, 17(2), 182-190.
[https://doi.org/10.15250/joie.2018.17.2.182]

-
Kantarci, N., Borak, F., Ulgen, K.O. (2005) Bubble column reactors, Process Biochemistry, 40(7), 2263-2283.
[https://doi.org/10.1016/j.procbio.2004.10.004]

-
Kim, K.Y. (2015) Seasonal field assessment of odor emitted from livestock manure composting facility, Journal of Livestock Housing and Environment, 21(2), 41-46.
[https://doi.org/10.11109/JAES.2015.21.2.41]

-
Ko, H.J., Choi, H.L., Kim, K.Y., Lee, Y.K., Kim, C.N. (2006) Evaluation of Odors and Odorous Compounds from Liquid Animal Manure Treated with Different Methods and Their Application to Soils, Journal of Animal Science and Technology, 48(3), 453-466.
[https://doi.org/10.5187/JAST.2006.48.3.453]

-
Lee, B.K., Lee, S.H., Tak, S.J., Lee, B.K. (2017) The Study on the Removal of Odor Emitting Environmental Fundamental Facility, Journal of Climate Change Research, 8(1), 51-56.
[https://doi.org/10.15531/ksccr.2017.8.1.51]

- Ministry of Environment (ME) (2020) Korean Statistical Information Service: Emission amount of chemicals.
- Park, Y.G., Kim, J.I. (2011) Efficiency Characteristics by Mixed Absorbents for the Removal of Odor Compounds in the Wet Scrubber, Applied Chemistry for Engineering, 22(1), 48-55.
-
Philippi, M., Santos, H.S., Martins, A.O., Azevedo, C.M.N., Pires, M. (2007) Alternative spectrophotometric method for standardization of chlorite aqueous solutions, Analytica Chimica Acta, 585, 361-365.
[https://doi.org/10.1016/j.aca.2006.12.053]

- Song, J.I., Jeon, J.H., Park, K.H., Yoo, Y.H., Kim, D.H. (2011) Conducted to Verify the Effect of Chlorine Dioxide (ClO2) on Odor Reduction at a Commercial Swine Facility, Journal of Livestock Housing and Environment, 17(suppl), 43-50.
-
Terasaka, K. (2010) Applications of Microbubble Technology for Various Fields, Oleoscience, 10(9), 323-328.
[https://doi.org/10.5650/oleoscience.10.323]

-
Yao, K., Chi, Y., Wang, F., Yan, J., Ni, M., Cen, K. (2016) The effect of microbubbles on gas-liquid mass transfer coefficient and degradation rate of COD in wastewater treatment, Water Science & Technology, 73(8), 1969-1977.
[https://doi.org/10.2166/wst.2016.018]

김완수 (서울시립대학교 환경공학과 대학원생)
동종인 (서울시립대학교 환경공학과 교수)
이수민 (경희대학교 환경학 및 환경공학과 대학원생)
조영민 (경희대학교 환경학 및 환경공학과 교수)