대기 유기질소화합물의 분석방법 및 농도
Copyright © 2018 Korean Society for Atmospheric Environment
Abstract
The analytical methods and their ambient levels of organic nitrogenous compounds such as nitrosamines, nitramines (nitroamines), imines, amides and nitro-polycyclic aromatic hydrocarbons (nitro-PAHs) in the atmosphere are summarized and discussed. Sampling for the analysis of organic nitrogenous compounds was mostly conducted using high volume air sampler. The direct liquid extraction (DLE) using sonification and the pressurized liquid extraction (PLE) using the accelerated solvent extraction (ASE) have been frequently employed for the extraction of organic nitrogenous compounds in the atmospheric samples. After extraction, clean-up via filtration and the solid phase extraction (SPE) and concentrations using nitrogen and rotary evaporator have been generally conducted but in some studies the clean-up and concentration steps have been omitted to prevent the loss of analyte and improve the recovery rate of the analytical procedure. Instrumental analysis was mainly carried out using gas chromatography (GC) or the high performance liquid chromatography (HPLC) coupled with the single quadrupole mass spectrometer or tandem mass spectrometer in the electron ionization (EI), positive chemical ionization (PCI) and negative chemical ionization (NCI) mode and analysis sensitivity of nitrosamines and nitramines were higher in NCI mode. Desirable sampling and analysis methods for analyzing particulate organic nitrogenous compounds are suggested.
Keywords:
Organic nitrogenous compounds in the atmosphere, Analytical methods, Nitrosamines, Nitramines (nitroamines), Imines, Amides, Nitro polycyclic aromatic hydrocarbons (nitro PAHs)1. 서 론
유기질소화합물 (organic nitrogenous compound)이란 질소 (N)를 포함한 유기성분으로 니트로사민 (nitrosamine), 니트라민 (nitramine; 니트로아민 (nitroamine)), 이민 (imine), 아마이드 (amide) 그리고 니트로 다방향족탄화수소 (nitro-PAHs) 등이 이에 속한다 (Ge et al., 2011a). 국제암연구소 (IARC, International Agency of Research on Cancer)는 니트로사민, 아마이드, 이민 및 니트로 다방향족탄화수소에 속하는 상당수의 유기질소화합물들을 IARC carcinogenic group 2A (probably carcinogenic to humans)와 2B (possibly carcinogenic to humans)로 분류하였다 (IARC, 2008). 니트라민의 발암성 (carcinogenicity)은 니트로사민보다 작다고 알려져 있지만, 동물실험 결과 그 인체위해성이 확인된 바 있다 (Scherf et al., 1989; Pliss et al., 1982).
대기 중 유기질소화합물은 직접 배출과 대기반응을 통해 대기 중에 존재한다. 니트로사민은 매립지 배출가스, 자동차 배기가스, 플라스틱 및 고무의 소각, 담배연기에 의해 대기 중으로 직접적으로 배출되며 (NTP, 2016), 아마이드는 소각로 배출가스, 자동차 배기가스와 담배연기 등에 의해 대기 중으로 배출된다 (Ge et al., 2011a; Simoneit et al., 2002). 또 니트로 다방향족탄화수소는 자동차 배기가스, 난방 및 담배연기로부터 배출된다 (Albinet et al., 2007).
유기질소화합물은 무기질소 (NOx, NH3)와의 광화학반응 또는 화석연료 연소 및 농업활동으로부터 배출된 아민의 대기반응을 통해 생성되기도 한다. 예를 들어 아민과 OH 라디컬이 반응하여 생성된 R2-N은 NO, NO2 그리고 HO2와의 반응을 통해 각각 니트로사민, 니트라민 그리고 이민이 생성된다 (Nielsen et al., 2011). 아민과 OH 라디컬의 또 다른 생성물인 R- NH-R과 O2 그리고 NO와의 연속반응을 통해 아마이드가 생성된다 (Nielsen et al., 2011). 니트로다방향족탄화수소는 대기 중 다방향족탄화수소와 OH, NO3 및 O3와 같은 산화제와의 가스상 또는 불균일 반응을 통해 생성된다 (Albinet et al., 2007).
이러한 유기질소화합물은 대기 중에서 광분해되어 제거되기도 하는데, 이에 따라 각각의 유기질소화합물들의 대기 중 체류시간은 상이하다. 예를 들어 니트로사민의 경우 대기 중에서 매우 빠르게 광분해되어 체류시간이 1시간 이내로 매우 짧은 데 반해, 니트라민, 아마이드와 니트로 다방향족탄화수소는 수일 동안 대기 중에 체류하여 대기 중에 높은 농도로 존재할 가능성이 있다 (Nielsen et al., 2012; Grosjean, 1991).
대기 중 유기질소화합물은 인체위해성이 크다고 알려져 있고 대기 중으로 직접배출되기도 하지만 대기반응을 통해 생성·제거되는 특성이 있어 이에 대한 연구는 미세먼지의 위해성 측면뿐 아니라 대기 중 유기질소화합물의 배출원 규명, 대기반응특성과 장거리 이동 특성을 이해하는 데에도 기여할 것으로 기대된다. 예를 들어, Akyüz and Ata (2013)는 총 13종의 니트로사민의 대기 중 농도를 보고하였으며, 니트로사민의 농도와 기상요소와의 상관관계 및 판별분석과 같은 통계분석을 통해 대기 중 니트로사민의 기여원을 규명한 바 있다. Pitts et al. (1975)은 챔버실험을 통해 아민으로부터 니트로사민, 니트라민 및 아마이드가 생성되는 반응의 수율 (yield)를 계산하여 유기질소화합물의 대기반응특성을 이해하고자 하였다. 또 Lafontaine et al. (2015)은 니트로 다방향족탄화수소 (1,8-dinitropyrene)를 지표물질로 설정하여 대기오염물질의 장거리이동특성에 관한 연구를 진행한 바 있다.
미세먼지를 구성하는 화학종에 대한 국내 연구는 주로 유기탄소성분에 국한하여 (Choi et al., 2016a), 유기질소화합물에 대한 이해는 부족한 실정이다 (Hong et al., 2017; Park et al., 2010; Yu et al., 2006; Kim et al., 2001). 대기 중 아민에 대한 총설 (Lee and Wexler, 2013; Ge et al., 2011a, b)에서는 아민의 대기 중 반응 특성, 물리·화학적 특성 및 독성에 대해 자세히 설명하고 있지만, 개별 유기질소화합물의 분석법 및 대기 중 농도분포에 대해 제시하고 있지 않다.
본 연구에서는 인체위해성이 크고 직접배출과 대기 중 생성반응을 통해 상당한 농도로 존재할 것으로 추측되는 니트로사민 및 니트로 다방향족탄화수소의 분석법을 정리하였다. 또 각 성분의 인체위해성이 크고, 니트로사민의 대기 중 반응특성을 이해하는 데 주요한 역할을 할 것으로 기대되는 니트라민, 이민 및 아마이드의 분석법 및 대기 중 농도분포를 문헌조사를 통해 정리하여 대기 중 유기질소화합물의 대기 중 광화학반응, 장거리 이동 특성 규명 및 관리대책수립에 관한 향후 연구에 기여하고자 한다.
2. 개별 유기질소화합물
2. 1 니트로사민
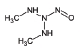
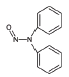
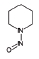
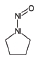
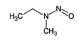
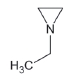
니트로사민은 니트로소 작용기 (-N=O)를 가지는 유기질소화합물의 일종으로 대부분이 IARC carcinogen-ic group 2A에서 2B에 포함되어있다 (IARC, 2008) (표 1). 니트로사민은 인체위해성에 대한 우려 때문에, 식수, 식품, 플라스틱·고무 제품 및 화장품에서 그 농도가 규제되거나 특정 농도 이상 포함하지 않도록 하거나, 니트로사민의 포함여부를 제품에 표기하도록 미국 환경청 (US EPA), 미국 식품의약국 (US FDA), 세계보건기구 (WHO)과 유럽연합 집행위원회 (EC) 등이 권고하고 있다 (WHO, 2008; EC, 1993; US FDA, 1984; US EPA, 1980, 1976a, b, 1972). 한국에서는 식품의약품안전청에서 플라스틱·고무 제형의 젖꼭지 제품에서의 니트로사민의 사용을 규제하고 있지만 (MFDS, 2013), 대기 중 니트로사민의 존재여부 및 농도에 관한 연구는 미비한 실정이다. 표 1에 그동안 진행된 대기 중 니트로사민 농도보고에 대한 연구에서 주로 대상물질로 다뤄졌던 니트로사민의 화학구조 및 독성을 정리하였다.
니트로사민은 플라스틱·고무의 연소 (NTP, 2016), 자동차 배기가스 (Ge et al., 2011a), 매립지 배출가스 (Fischer et al., 1999), 담배연기 (Aragón et al., 2013) 및 조리과정 (Nerín et al., 2016; Sen et al., 1976)에서 직접 대기 중으로 배출된다. 또 아민을 이용한 연소 후 탄소포집 (post-combustion CO2 capture (PCC)) 공정 시, 아민의 산화반응을 통해 니트로사민이 배출되기도 한다 (Lindahl et al., 2014).
니트로사민은 아민의 대기 중 산화반응으로 생성되기도 하며, 햇빛에 의해 광분해되어 대기 중에서 제거되기도 하는데, 니트로사민의 대기 중 체류시간은 수시간 이내로 매우 짧다고 알려져 있다 (Nielsen et al., 2011; Grosjean, 1991; Pitts et al., 1978). 하지만 Nielsen et al. (2012)의 챔버실험 결과에서는 대기 중 아민과 질소산화물의 반응을 통해 입자상 니트로사민이 생성되며, 생성된 입자상 유기질소화합물의 숙성은 휘발성을 낮추고, 대기 중 체류시간을 증가시킨다고 보고하고 있다.
1970년대에는 산업시설이 밀집한 지역에서 대기 중 니트로사민의 농도가 빈번히 보고되었으나, 1990년대 니트로사민의 대기거동특성에 관한 연구를 통해 대기 중 니트로사민은 광분해되어 도심 대기 중 니트로사민의 농도가 낮을 것이라고 추측되었기 때문에 한동안 니트로사민의 대기 중 농도에 대한 연구는 진행되지 않았다. 2010년대 들어서는 니트로사민의 농도가 꽤 상당한 농도로 존재한다는 사실에 입각하여, 니트로사민의 도심 대기 중 농도 및 기여원 규명에 대한 연구가 진행되었다. 대기 시료 중 니트로사민의 분석을 위한 대기시료의 채취, 추출법, 추출용매, 정제, 농축, 기기분석 조건 및 정도관리 결과 (회수율, 방법검출한계 (MDL), 검출한계 (LOD))를 표 2에 정리하였다.

Analytical methods and measured concentrations of nitrosamines in the airborne samples in the previous studies.
1970년대의 대기 중 니트로사민의 분석은 연속동결트랩 (Fine et al., 1976)과 글래스 임핀저 (Fajen et al., 1979)를 사용한 채취를 통해 디클로로메테인 (DCM) 용매를 사용하여 직접액체추출법으로 추출하였다 (Fajen et al., 1979; Fine et al., 1976). 또 데니쉬 (Danish) 농축기를 사용하여 농축한 다음 가스-액체 크로마토그래피 (GLC), 가스크로마토그래피 (GC), 고성능 액체크로마토그래피 (HPLC)와 열에너지검출기 (TEA), 질량분석 (MS) 검출기를 이용하여 니트로사민을 분석하였다 (Fajen et al., 1979; Fine et al., 1976).
최근에 수행된 니트로사민 분석을 위한 대기 시료의 채취는 일반적으로 고유량 에어샘플러 (Farren et al., 2015; Akyüz and Ata, 2013; Aragón et al., 2013; Hutchings et al., 2010) 또는 사이클론 채취기 (Hong et al., 2017)를 사용하였다. 이때, 시료채취 여과지는 석영여과지 (Hong et al., 2017; Farren et al., 2015; Aragón et al., 2013; Hutchings et al., 2010)를 주로 사용하였고, Akyüz and Ata (2013)는 테프론 (PTFE) 여과지를 사용하여 니트로사민 분석을 위한 대기시료를 채취하였다. 또 실내 대기 중 니트로사민 분석을 위한 대기시료 채취 시 진공청소기를 사용해 시료를 채취하였으며 (Ramírez et al., 2012), Nielsen et al. (2011)의 챔버실험에서는 가스상 니트로사민 분석을 위해 Thermosorb/N 카트리지와 차콜 카트리지를 사용하기도 하였다 (Nielsen et al., 2011).
초음파 추출을 이용한 직접액상 추출법 (Akyüz and Ata, 2013; Nielsen et al., 2011; Hutchings et al., 2010)과 가속용매추출법 (accelerated solvent extraction, ASE)을 이용한 가압액체추출법 (PLE) (Farren et al., 2015; Aragón et al., 2013; Ramírez et al., 2012)이 니트로사민의 추출법으로 주로 사용되었다. 표 2에서 보듯이 가압액체추출법 (Farren et al., 2015; Aragon et al., 2013)을 사용한 분석법의 회수율이 직접액체추출법을 적용한 분석법 (Hong et al., 2017; Akyüz and Ata, 2013)의 회수율보다 낮았는데, 이는 니트로사민의 휘발성이 매우 높아 가압액체추출법을 적용한 분석과정에서 손실이 발생하였을 가능성 (Hong et al., 2017; Choi et al., 2016b)을 시사한다.
추출 용매로는 증류수 (Akyüz and Ata, 2013; Hutchings et al., 2010), 에틸아세테이트 (Farren et al., 2015; Aragón et al., 2013; Ramírez et al., 2012), 디클로로메테인 (Hong et al., 2017), 메틸렌클로라이드와 메탈올 혼합액 (3 : 1, v/v) (Nielsen et al., 2011)이 사용되었다. 정제과정에는 주로 여과지 (Hong et al., 2017; Akyüz and Ata, 2013; Ramírez et al., 2012)와 고체상추출법 (SPE)이 정제방법으로 사용되었다. 정제 후에는 질소농축기 (Farren et al., 2015; Akyüz and Ata, 2013; Nielsen et al., 2011; Hutchings et al., 2010) 및 회전증발농축기 (Aragón et al., 2013)를 사용하여 농축과정을 거치기도 하였으나, 니트로사민의 높은 휘발성 때문에 정제과정 (Farren et al., 2015; Aragón et al., 2013; Nielsen et al., 2011)과 농축과정 (Hong et al., 2017)은 생략되기도 한다.
니트로사민의 분석을 위해서는 가스크로마토그래피가 주로 사용되었고 (Hong et al., 2017; Farren et al., 2015; Akyüz and Ata, 2013; Aragón et al., 2013; Ramírez et al., 2012; Nielsen et al., 2011; Hutchings et al., 2010), 분리관은 무극성컬럼인 ZB-5MS (Akyüz and Ata, 2013; Ramírez et al., 2012), 중간극성컬럼인 DB-1701P (Hutchings et al., 2010)와 RTX-1701 (Nielsen et al., 2011) 및 극성컬럼인 Stabilwax 컬럼 (Hong et al., 2017)이 사용되었으며, 두 컬럼을 연결하여 연속적 분리가 가능한 이차원 가스크로마토그래피 (GC/GC)를 사용한 연구에서는 첫번째 컬럼은 중간극성을 띄는 DB-5MS컬럼, 두번째 컬럼은 중간극성인 BPX-50컬럼을 사용하여 분리 정확도를 높였다 (Farren et al., 2015).
니트로사민 분석을 위한 검출기로는 주로 단일 사중극자 질량분석기 (single quadrupole MS)가 사용되었고 (Hong et al., 2017; Akyüz and Ata, 2013; Aragón et al., 2013; Ramírez et al., 2012; Nielsen et al., 2011; Hutchings et al., 2010), 전자이온화 (EI)법 (Akyüz and Ata, 2013; Ramírez et al., 2012)과 화학이온화 (CI)법 (Hutchings et al., 2010)이 사용되었다. 특히, Nielsen et al. (2011)은 양이온 화학이온화법 (PCI)과 음이온 화학이온화법 (NCI)을 모두 이용하였다. 분석 결과 두 이온화법 모두에서 니트로사민이 검출되었지만, 음이온 화학이온화법의 감도가 더 높았다 (Nielsen et al., 2011). 또 화학 이온화법을 통한 이중질량분석기 (tandem MS, MS/MS) (Hong et al., 2017; Aragón et al., 2013)와 Nitrogen Chemiluminescence Detector (NCD) (Farren et al., 2015)를 사용하여 니트로사민을 분석하였다.
지금까지의 니트로사민 분석 연구 결과에 따르면 입자상 니트로사민의 채취를 위해서는 석영여과지를 장착한 고유량 공기채취기가 가장 빈번하게 사용되고 있음을 알 수 있다. 또 휘발성이 강한 니트로사민의 분석을 위해서는 직접액상추출법을 사용하여 추출하는 것이 니트로사민의 손실을 최소화 할 것이며, 니트로사민의 회수율을 높이기 위해 정제 및 농축과정을 최소화 하는 것이 필요할 것이다. 또한 가스크로마토그래피와 질량분석기를 사용하여 니트로사민의 정성 및 정량분석이 가능할 것으로 판단되며, 분석 감도를 높이기 위해 극성의 가스크로마토그래피 컬럼과 질량분석기 적용 시 음이온 화학 이온화법을 사용하는 것이 권장된다.
니트로사민은 대기 중에서 태양광에 의해 매우 빠르게 제거되어 도심 대기 중에는 니트로사민의 적은 농도로 존재할 것으로 가정되어왔기 때문에 (Grosjean, 1991; Shapley, 1976), 대기 중 니트로사민 분석에 관한 연구는 충분히 수행되지 않았다. 따라서 표 2에서 보듯 1970년대의 대기 중 니트로사민에 관한 연구는 주로 공장이 밀집된 지역에서의 연구에 국한하였다 (Fajen et al., 1979; Fine et al., 1976).
최근에는 도심지역에서의 니트로사민의 농도는 빈번히 보고되고 있는 추세이다 (Hong et al., 2017; Aragón et al., 2013; Ramírez et al., 2012). 발표된 연구들에 따르면 도심에서의 니트로사민의 농도는 상당하였는데, 그 농도는 지금까지 주요 발암물질로 여겨져 대기 중 농도가 많이 보고된 다방향족탄화수소 (PAHs)의 서울 대기 중 농도 (Choi et al., 2016a)와 비슷한 수준 (0.99±1.06 ng/m3; 일평균농도 (총 13종))이었다 (Hong et al., 2017; Farren et al., 2015; Akyüz and Ata, 2013; Aragón et al., 2013; Hutchings et al., 2010). 이는 광분해로 대기 중에서 제거되는 니트로사민의 양보다 광화학반응과 암반응을 통해 생성되는 니트로사민의 양이 많았거나 다른 대기 중 생성반응을 통해 니트로사민이 대기 중에 생성되었을 것임을 시사한다. 또는 일차 배출원을 통해 상당한 양의 니트로사민이 대기 중으로 배출되었을 것임을 추측할 수 있다.
Hong et al. (2017)에서는 서울에서 채취한 총 9종의 니트로사민의 대기 중 농도를 보고하고 있는데 거주지역에 비해 도로변에서의 니트로사민의 농도가 다소 높았다. 서울에서의 니트로사민의 농도는 Hutchings et al. (2010)에서 보고한 미국의 농업 및 거주지역의 니트로사민의 농도에 비해 낮았으며, Aragón et al. (2013)과 Farren et al. (2015)에서 보고한 스페인 Tarragona와 영국 North Kensington과 같은 도심지역에서의 니트로사민의 농도와는 비슷하였다. 또 터키의 도심지역인 Zonguldak의 겨울 평균농도는 서울 도로변의 니트로사민의 농도와 비슷하였으며, 여름 평균농도는 서울 거주지역의 니트로사민의 농도와 비슷하였다.
2. 2 니트라민, 이민 및 아마이드
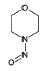
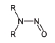
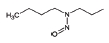
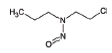
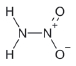
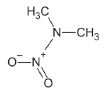
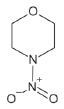
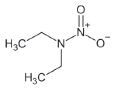
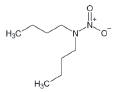
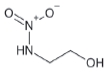
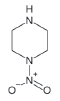
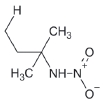
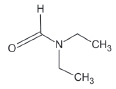
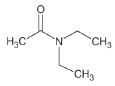
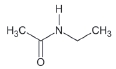
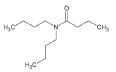
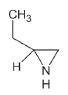
대기 중 니트라민, 아마이드 및 이민은 니트로사민과 함께 아민의 주요 광화학반응 생성물이다. 니트라민과 아마이드는 각각 니트로기 (-NO2)와 카르보닐기 (C=O)를 포함하는 유기질소화합물을 말하고, 이민은 질소 (N)와 알킬기 (R) 사이에 이중결합을 갖는 유기질소화합물이다 (표 3). 먼저 니트라민은 니트로사민보다 급성독성은 낮지만 대기 체류시간이 길어 만성적으로 노출될 경우 니트라민의 인체위해성은 니트로사민보다 높을 가능성이 있다고 추측된다 (Lindahl et al., 2014). 또 아마이드와 이민에 속하는 대다수의 유기질소화합물들은 그 인체 위해성은 입증된 바 없지만 몇몇 아마이드 (IARC carcinogenic group 1: Cyclophosphamide; 2A: Dimethylformamide, Dimethylformamide, Acrylamide; 2B: Acetamide, Thioacetamide, Hexamethylphosphoramide)와 이민 (IARC carcinogenic group 2B: Propyleneimine)은 IARC carcinogenic group 2A와 2B에 속하여 있어 (IARC, 2008), 대기 중 아마이드와 이민성분이 인체위해성을 가질 가능성을 배제할 수 없다. 현재까지 대기 중 니트라민, 이민 및 아마이드에 관한 연구논문에서 주로 언급된 개별 니트라민, 이민 그리고 아마이드 CAS 번호, 분자식, 분자량, 확인 가능한 독성정보 그리고 화학구조를 표 3에 나타내었다.
아마이드는 매립지 배출가스, 생체 소각과 조리과정 중에 대기 중으로 직접 배출된다 (Ge et al., 2011a; Simoneit et al., 2002). 또 니트라민은 다양한 연료의 연소 시 그리고 연소 후 탄소포집 기술 사용 시에 대기 중으로 배출된다고 알려져 있지만 (Lindahl et al., 2014), 니트라민과 아마이드 그리고 이민은 대기 중으로 직접 배출되기보다는 반응을 통해 대기 중에 존재한다 (Lindahl et al., 2014; Maguta, 2014; Nielsen et al., 2011).
특히 니트라민은 연소 후 탄소포집 기술에서 사용되는 아민의 산화반응을 통해 대기 중에 높은 농도로 배출될 것으로 추측된다. 또 아마이드는 질소를 포함한 전체 휘발성 유기화합물 (NVOCs)에서 상당히 큰 비중을 차지하는 유기질소화합물 (Carter, 1994)이다. 그리고 이민은 아민의 산화반응 생성물이기 때문에 대기 중 니트라민, 아마이드, 이민의 농도와 거동 특성에 대한 관심이 높아지고 있는 추세이다 (Lindahl et al., 2014).
니트라민, 아마이드 및 이민은 니트로사민 생성반응과정 중에서 아민의 산화반응을 통해 생성된다 (반응 (1)~(7)). 예를 들어, 디메틸아민 ((CH3)2NH)의 산화반응을 통해 생성된 (CH3)2N은 대기 중 NO, NO2, 그리고 O3와의 반응을 통해 디에틸니트로사민 (반응 (9)), 디에틸니트라민 (반응 (10)), 디에틸이민 (반응 (11))을 생성한다. 또 디에틸아민의 산화반응 생성물인 (CH3)N(H)CH2 (반응 (12))는 O2 그리고 NO와의 반응 (반응 (13))을 통해 메틸아세타마이드 (반응 (14))를 생성한다 (Nielsen et al., 2011). Lindley et al. (1979)에서는 니트로사민, 니트라민 그리고 이민의 생성반응의 상대적 반응속도가 k8/k9=(1.48±0.07)×10-6, k8/k10=(3.90±0.28)×10-7, k11/k10=0.22±0.06으로 니트라민의 생성반응의 반응속도상수가 니트로사민과 이민 생성반응의 반응속도상수보다 컸다. Tauzen et al. (1984)에서는 니트로사민과 니트라민의 생성반응의 절대적 반응속도상수를 구하였는데, 각각 k3=(8.53±1.42)×10-14와 k4=(3.18±0.48)×10-13 cm3/molecule·sec (300 K)으로 니트라민 생성반응의 반응속도상수가 더 컸다.
| (8) |
| (9) |
| (10) |
| (11) |
| (12) |
| (13) |
| (14) |
니트로사민은 대기 중 매우 빠르게 광분해된다고 알려져 있는데, 니트로사민의 광분해산물인 H3C-N-CH3는 NO2와의 반응을 통해 니트라민을 생성하고, O2 및 NO2와의 반응을 통해 이민을 생성한다. Nielsen et al. (2011)의 챔버실험에서도 디메틸아민이 광분해하면서 디메틸니트라민과 메틸메탄이민 그리고 소량의 니트로메테인과 포름알데히드가 생성되는 것을 확인하였다. 이들 유기질소화합물들의 대기 중 체류시간은 상이한데, 니트로사민의 경우 대기 중에서 매우 빠르게 광분해되어 체류시간이 1시간 이내로 매우 짧은 데 반해, 니트라민, 아마이드와 니트로 다방향족탄화수소는 수일 동안 대기 중에 체류하여 대기 중에 높은 농도로 존재할 가능성이 있다 (Nielsen et al., 2012; Grosjean, 1991).
이렇듯 니트라민, 이민 그리고 아마이드의 대기 중 농도에 대한 연구는 유기질소화합물의 대기 반응특성을 이해하는 데 주요하게 기여할 것으로 예상되나, 실제 대기에서의 농도측정에 대한 연구는 거의 진행된 바 없다. 하지만 이들 화합물의 대기 중 반응을 통한 생성여부를 챔버실험을 통해 확인한 연구는 진행된 바 있다 (Nielsen et al., 2011; Erupe et al., 2008; Masuda et al., 2000; Pitts et al., 1978).
챔버실험에서 보고된 니트라민, 이민 및 아마이드의 분석법 및 적용된 분석방법의 정도관리 결과를 표 4에 정리하였다. 먼저 Nielsen et al. (2011)에서는 2종의 니트라민 (nitro-methylamine, nitro-dimethylamine)을 분석하였고, Thermosorb/N과 차콜 카트리지 흡착제를 사용하여 가스상의 니트라민을 채취하였다. 메틸렌클로라이드와 메탄올 혼합액 (3 : 1, v/v)을 추출용매로 선택하여 직접액체추출 (DLE)법을 사용해 추출한 후, 중간극성컬럼인 RTX-1701을 설치한 가스크로마트그래피와 양이온 화학 이온화법과 음이온 화학 이온화법을 채택하여 질량분석기를 사용하여 니트라민을 분석하였다. 그 결과 음이온 화학 이온화법을 채택한 실험방법에서의 분석 감도가 더 높았음을 확인하였다 (Nielsen et al., 2011). Nielsen et al. (2011)의 실험에서는 오존 스크루버를 사용한 시료채취 단계에서 사용한 분석 결과와 사용하지 않은 분석 결과도 제시하였는데, 시료채취 단계에서의 오존 스크루버의 사용여부는 분석 결과에 큰 영향을 미치지 않았다 (Nielsen et al., 2011).
니트라민에 속하는 nitro-morpholine을 분석한 Masuda et al. (2000)의 반응기실험에서도 디클로로메테인을 추출용매로 한 직접추출법을 사용하였으며, 무극성칼럼인 HP-1컬럼을 설치한 가스크로마토그래피와 열에너지검출기를 분석기기로 채택하였다. 이때, 기기분석 전 디아조메탄을 사용하여 니트라민을 무극성화하는 유도체화과정을 거쳐 분석 감도를 높였다. 유도체화를 통해 무극성화된 니트라민은 무극성의 가스크로마토그래피 컬럼 (HP-1)을 통해 분석되었다 (Masuda et al., 2000).
Pitts et al. (1978)에서는 1종의 니트라민 (diehtylnitramine)과 3종의 아마이드 (diehtylformide, diehtylacetaide, ethlyacetamide)를 분석하였다. Pitts et al. (1978)의 챔버실험에서는 고유량채취기가 가스상 및 입자상 시료 채취를 위해 사용되었으며 디클로로메테인을 사용한 직접추출법이 추출법으로 사용되었다. 추출된 시료는 여과 (filtration)를 사용하여 정제되었고, 극성을 띄는 Ucon HP컬럼을 사용한 가스크로마토그래피와 질량분석기 (전자 이온화 모드)를 사용하여 분석되 었다.
Erupe et al. (2008)에서는 양성자전이 질량분석법 (Proton Transfer Reaction - Mass Spectrometry, PTR-MS)과 고분해능 비행시간 에어로졸 질량분석기 (HR-ToF-AMS)를 사용하여 2종의 니트라민, 4종의 아마이드 그리고 2종의 이민을 실시간으로 분석하였다. Dye et al. (2011)에서는 총 4종의 니트라민을 분석하였는데, 먼저 임핀저를 사용하여 대기 시료를 채취하였고, 차콜 카트리지를 사용한 고상추출법으로 시료를 정제하였고, 질소 농축기를 활용하여 농축한 시료를 고성능액체크로마토그래피 (HPLC)와 고분해능질량분석기 (HRMS)를 사용하여 분석하였다.
입자상 니트라민과 아마이드의 동시 분석을 위한 시료채취방법은 Pitts et al. (1978)에서 보고된 분석법이 유일하다. 따라서 입자상 니트라민과 아마이드 분석을 위해서는 고유량 공기채취기를 사용한 다음 대기 시료 채취를 통해 초음파추출을 통한 직접액상추출법을 적용하여 여과와 농축을 통한 전처리 과정을 거치는 것이 권장된다. 또 가스크로마토그래피와 전자 이온화법을 적용한 질량분석기를 사용하여 니트라민과 아마이드를 분석할 수 있을 것으로 판단된다. 이때 극성의 가스크로마토그래피 컬럼을 사용하고 질량분석기의 모드를 음이온 화학 이온화법을 채택하여 니트라민과 아마이드의 분석 감도를 높일 수 있을 것으로 판단된다.
Masuda et al. (2000)에서는 니트라민을 유도체화하여 무극성화 한 다음 무극성의 가스크로마토그래피 컬럼을 통해 분석하였다. 하지만 Nielsen et al. (2011)과 Pitts et al. (1978)에서는 니트라민을 유도체화하지 않고 각각 중간극성과 극성의 가스크로마토그래피 컬럼을 통해 분석해낸 바 있다. 이들 연구를 통해 볼 때, 유도체화 과정을 거치지 않고 니트라민을 분석할 수 있을 것으로 판단된다.
대기 중 이민의 분석법은 Erupe et al. (2008)에서 보고된 챔버실험에서 양성자전이 질량분석기와 고분해능 비행시간 에어로졸 질량분석기를 사용한 분석법이 유일하다. 따라서 입자상 이민의 분석은 분자구조가 비슷한 아마이드의 분석법을 따라 시도될 수 있을 것으로 판단된다.
2. 3 니트로 다방향족탄화수소
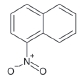
니트로다방향족탄화수소는 방향족탄화수소에 하나 이상의 니트로기 (-NO2)를 포함하는 유기질소화합물으로, 대부분의 니트로다방향족탄화수소는 IARC carcinogenic group에서 주로 2A와 2B에 속한다 (IARC, 2008) (표 5). 표 5에 니트로 다방향족탄화수소의 CAS 번호, 분자식, 분자량, 독성정보 그리고 화학구조를 나열하였다. 니트로다방향족탄화수소는 다양한 형태의 연소과정 중에 배출되거나 대기 중 다방향족탄화수소와 OH, NO3 및 O3와 같은 산화제와의 가스상 또는 불균일 반응을 통해 생성되는데 (Albinet et al., 2007), 니트로다방향족탄화수소는 대기 중 체류시간이 길어 다방향족탄화수소보다 돌연변이성 (2×105배)과 발암성 (10배)이 더 높다고 알려져 있다 (Lewtas et al., 1990). 이처럼 대기 중 니트로다방향족탄화수소의 긴 체류시간 때문에, 니트로다방향족탄화수소는 장거리이동의 지표물질로 사용되기도 한다 (Lafontaine et al., 2015).
니트로다방향족탄화수소의 분석방법 및 적용된 분석방법의 정도관리 결과를 표 6에 정리하였다. 대기 중 니트로다방향족탄화수소의 분석 연구는 현재까지 활발하게 수행되어 왔기 때문에, 비교적 최근 논문들을 인용하였다.

Analytical methods and measured concentration of nitro-polycyclic aromatic hydrocarbons (nitro-PAHs) in the airborne samples in the previous studies.
대부분의 연구에서 니트로다방향족탄화수소의 분석을 위한 대기 시료의 채취는 주로 고유량 에어샘플러 (Alam et al., 2015; Lafontaine et al., 2015; Chuesaard et al., 2014; Barrado et al., 2013; Hernandez et al., 2010; Albinet et al., 2007)가 사용되었고, 또 사이클론 에어샘플러 (Bamford et al., 2003), 저용량 에어샘플러 (Alves et al., 2017) 및 중용량 에어샘플러 (Li et al., 2016)가 사용되기도 하였다. 추출법은 초음파추출법을 사용한 직접추출법 (Li et al., 2016; Alam et al., 2015; Chuesaard et al., 2014; Hernandez et al., 2010; Tang et al., 2005), 가속용매추출법을 사용한 가압액체추출법 (Alves et al., 2017; Lafontaine et al., 2015; Ringuet et al., 2012; Albinet et al., 2007) 그리고 속실렛 (Soxhlet)을 사용한 액체추출법 (Barrado et al., 2013; Bamford et al., 2003)이 사용되었고, 추출용매로는 디클로로메테인 (Alam et al., 2015; Lafontaine et al., 2015; Chuesaard et al., 2014; Barrado et al., 2013; Ringuet et al., 2012; Albinet et al., 2007; Bamford et al., 2003), 메틸렌클로라이드 (Hernandez et al., 2010), 아세톤/디클로로메테인 혼합액 (2 : 1, v/v) (Alves et al., 2017), hexane/acetone (Li et al., 2016) 및 벤젠/에탄올 혼합액 (ben-zene/ethanol) (3 : 1, v/v) (Tang et al., 2005)이 사용되었다.
정제과정에는 정제 컬럼을 이용한 고상추출법 (Alves et al., 2017; Li et al., 2016; Alam et al., 2015; Lafontaine et al., 2015; Ringuet et al., 2012; Bamford et al., 2003), 멤브레인 여과지를 이용한 여과 (Chuesaard et al., 2014, Hernandez et al., 2010; Tang et al., 2005)가 사용되었다. 농축과정에서는 질소농축기 (Alam et al., 2015; Ringuet et al., 2012; Albinet et al., 2007), Turbo Vap II 농축기 (Alves et al., 2017; Lafontaine et al., 2015), 회전증발농축기 (Barrado et al., 2013; Hernan-dez et al., 2010) 그리고 원심 농축기 (Chuesaard et al., 2014)가 사용되었으며, 몇몇 연구에서는 농축과정을 생략하기도 하였다 (Li et al., 2016; Tang et al., 2005; Bamford et al., 2003).
대기 중 니트로다방향족탄화수소의 분석을 위한 분석기기로는 가스크로마토그래피 (Alves et al., 2017; Li et al., 2016; Alam et al., 2015; Lafontaine et al., 2015; Ringuet et al., 2012; Hernandez et al., 2010; Albinet et al., 2007; Bamford et al., 2003)와 고성능액체크로마토그래피 (Chuesaard et al., 2014; Barrado et al., 2013)가 주로 사용되었다. 가스크로마토그래피 컬럼으로는 HP-5MS (Li et al., 2016; Alam et al., 2015), DB-5MS (Alves et al., 2017; Ringuet et al., 2012; Albinet et al., 2007; Bamford et al., 2003), DB-17MS (Bamford et al., 2003)와 HP50+MS (Hernandez et al., 2010)가 사용되었고, 고성능 액체크로마토그래피의 컬럼은 C18 (Chuesaard et al., 2014; Barrado et al., 2013)과 NPpak RS 컬럼 (Chuesaard et al., 2014)이 사용되었다. 검출기로는 단일 사중극자 질량분석기 (Alves et al., 2017; Li et al., 2016; Lafontaine et al., 2015; Ringuet et al., 2012; Hernandez et al., 2010; Albinet et al., 2007; Bamford et al., 2003)가 주로 사용되었으며, 그 밖에 이중 질량분석기, 형광검출기 (Barrado et al., 2013), 그리고 화학섬광검출기 (Chuesaard et al., 2014; Tang et al., 2005)가 사용되기도 하였다. 질량분석기의 이온화는 전자이온화 모드 (Alam et al., 2015; Lafontaine et al., 2015) 및 음이온 화학이온화 모드 (Alves et al., 2017; Li et al., 2016; Ringuet et al., 2012; Hernandez et al., 2010; Albinet et al., 2007; Bamford et al., 2003)를 이용하였다.
표 6에서 보듯 대기 중 입자상 또는 가스상 니트로다방향족탄화수소의 농도분포 및 주요 기여원 규명 (직접배출 (primary reaction) 또는 이차생성 (secondary reaction), 장거리 이동에 의한 유입)을 위한 연구는 많이 진행된 바 있지만, 서울에서의 니트로다방향족탄화수소의 농도 및 주요 기여원 규명을 위한 연구는 거의 진행된 바 없다 (Park et al., 2010; Tang et al., 2005). Park et al. (2010)의 연구에서는 하수슬러지 소각시설 및 발전시설에서 니트로다방향족탄화수소를 채취하여 분석하였는데, 공장발전시설에서의 농도는 약 0~2 μg/m3, 하수슬러지 소각시설에서의 농도는 0~5 μg/m3 수준이었다. 또 Tang et al. (2005)에서는 동아시아 지역의 니트로다방향족탄화수소의 배출원 관련성을 조사하기 위해 중국 (Shenyang), 러시아 (Vladivostok), 한국 (Seoul), 일본 (Kanazawa, Sapporo, Tokyo, Kitakyushu)의 총 7개 도시에서의 니트로다방향족탄화수소 농도를 보고하였는데, 서울의 니트로다방향족탄화수소의 겨울 평균 농도는 3.6~716 fmol/m3이었으며, 여름 평균 농도는 보고하지 않았다. 겨울철 니트로다방향족의 농도는 중국 (Shenyang)과 일본 (Sapporo)보다 낮았지만, 러시아 (Vladivostok)와 일본의 3개 도시 (Kanazawa, Tokyo, Kitakyushu)보다는 높았다.
Choi et al. (2016a)에 따르면 서울에서 다방향족탄화수소의 농도는 0.02~27.48 ng/m3로, 이는 표 6에 정리된 실제 대기 중 니트로다방향족탄화수소의 농도와 비슷한 수치였거나 (Alves et al., 2017), 다소 낮은 농도 분포를 보였다 (Alam et al., 2015; Chuesaard et al., 2014; Ringuet et al., 2012; Hernandez et al., 2010; Albinet et al., 2007; Barrado et al., 2003). 따라서 서울에서의 니트로다방향족탄화수소의 농도도 다방향족탄화수소의 농도와 비슷하거나 다소 낮을 것으로 추측된다. 또 도심지역이 교외지역보다 다방향족탄화수소의 농도가 높았고 (Albinet et al., 2007), 겨울에 여름보다 높은 농도 분포추이를 보였다 (Alves et al., 2017; Hernandez et al., 2010). 또 도로주변에서는 낮에 밤보다 니트로다방향족탄화수소의 농도가 더 높았으나, 교외지역에서는 밤에 낮보다 니트로다방향족탄화수소의 농도가 더 높은 특성을 보였다 (Ringuet et al., 2012).
3. 요약 및 제언
대기 중 에어로졸을 생성하는 화학반응은 초미세먼지 생성 및 화학조성변화에 중요한 역할을 한다. 하지만 그동안의 에어로졸의 대기반응에 관한 연구는 주로 유기탄소나 유기산소성분에 국한되어, 초미세먼지의 주요 기여원을 총체적으로 규명하는 데 제한이 있었다. 에어로졸의 유기질소화합물은 대기 중 농도가 낮고 그 중요성에 대한 정보가 많지 않아, 일부 특정성분 (PANs, peroxyacyl nitrates) 외에는 연구가 충분히 수행되지 않았다.
유기질소화합물은 대기 중에서의 반응과정에 깊이 참여되고 있어, 대기 중 유기질소화합물에 대한 연구는 대기 에어로졸의 주요 기여원을 총체적으로 이해하는 데 크게 기여할 것으로 판단된다. 특히 니트로사민, 니트라민, 아마이드, 이민 및 니트로다방향족탄화수소와 같은 유기질소화합물은 대부분 인체위해성을 갖는다고 알려져 있어 대기 중 유기질소화합물의 농도를 보고할 필요성이 있다. 본 연구는 대기 중 유기질소화합물의 농도를 보고하고 유기질소화합물의 대기거동특성을 이해하는 데 기여할 것이며, 궁극적으로 초미세먼지의 농도저감정책을 수립하는 데 있어 과학적 근거를 제시하는 데 기여할 것으로 판단된다.
입자상 니트로사민, 니트라민, 아마이드 그리고 니트로 다방향족탄화수소의 분석을 위한 시료채취는 주로 고유량 공기채취기를 사용하여 진행되었다. 또 시료의 전처리과정에서는 분석체의 손실을 최소화하고 회수율을 높이기 위해 직접액상추출법이 주로 채택되었고 시린지 (Syringe) 여과지를 사용한 간단한 정제과정을 거쳤으며, 정제와 농축과정은 생략되기도 하였다. 전처리과정을 거친 시료는 주로 가스크로마토그래피와 질량분석기를 사용하여 분석되었는데, 이때 니트로사민과 니트라민은 극성의 가스크로마토그래피 컬럼과 질량분석기의 음이온법을 사용하였을 시에 더 높은 분석 감도로 분석되었다. 또 니트로사민, 니트라민, 아마이드 그리고 니트로다방향족탄화수소의 분석은 질량분석기의 이온화 모드는 전자, 양이온 및 음이온 화학 이온화 모드 모두에서 가능하였다. 하지만 니트로사민과 니트라민은 음이온 화학 이온화 모드에서 분석 감도가 높게 분석되었다.
입자상 니트로사민, 니트라민, 아마이드, 이민 그리고 니트로 다방향족탄화수소의 동시분석을 위해서는 먼저 고유량 공기채취기를 활용한 시료채취가 선행되어야 한다. 샘플링 시 오존 스크루버 사용여부에 따른 분석 결과의 차이는 없었기 때문에 (Nielsen et al., 2011), 샘플링 시 오존 스크루버를 사용할 필요성은 없다. 샘플링 된 대기 시료는 가압 액체추출법보다는 직접액상 추출법을 활용하여 회수율을 높일 수 있을 것으로 판단된다. 그 후에 시린지 필터를 활용한 간단한 정제과정을 거쳐 질소 농축기를 사용하여 정제된 대기시료를 농축한다. 전처리가 완료된 대기시료는 가스크로마토그래피와 질량분석기를 통해 동시분석이 가능할 것으로 예상된다. 이때, 니트로사민 니트라민, 아마이드, 이민 그리고 니트로 다방향족탄화수소는 극성을 띠기 때문에 극성의 가스크로마토그래피의 컬럼을 사용할 시 보다 높은 분석 감도로 분석될 것으로 기대된다. 또 니트로사민과 니트라민은 음이온 화학 이온화 모드에서 분석 감도가 높게 분석되었기 때문에 (Nielsen et al., 2011) 유기질소화합물을 동시 분석할 시에 음이온 화학 이온화 모드를 사용하는 것이 권장된다.
대기 중 입자상 유기질소화합물의 분석 연구는 그동안 유기탄소화합물에 국한하였던 유기에어로졸 연구를 확장하여 개별 유기화합물의 대기 중 농도 데이터를 총체적으로 구축하는 데 기여할 것이다. 분석된 유기질소화합물의 농도는 유기탄소화합물의 농도와 함께 다양한 통계분석 및 수용모델 등에 활용되어, 대기 중 유기에어로졸의 기여원을 보다 총체적으로 이해하는 데도 기여할 것으로 판단된다. 또 대기 중 NO2 : NO 비, 기상조건 (상대습도, 온도 등), 산화제 (i.e. OH, NO3)의 농도에 따라 생성되는 대기 중 니트로사민, 니트라민, 아마이드 및 이민과 같은 유기질소화합물이 상이하기 때문에 (Nielsen et al., 2011), 대기 중 유기질소화합물의 계절별, 밤낮 농도분포 추이 및 도심지역과 배경지역의 농도를 측정하여 실제 대기에서 유기질소화합물이 생성·제거되는 대기 특성을 파악할 수 있을 것으로 기대된다. 이를 통해 대기 중 유기질소화합물 분석 연구는 대기 중 이차 생성 유기 에어로졸 (secondary organic aerosols, SOAs)이 생성되는 대기 특성을 유추하고, 더 나아가 대기 중 미세먼지 관리방안을 모색하는 데 기여할 것으로 판단된다. 특히 니트로 다방향족탄화수소와 같은 유기질소화합물은 대기 중 체류시간이 길다고 알려져 있어 대기 중 유기질소화합물의 분석 연구는 장거리 이동에 따른 미세먼지의 대기 중 유입영향을 규명하는 데에도 기여할 것이다 (Lafon-taine et al., 2015).
Acknowledgments
본 연구는 한국연구재단의 지원을 받아 수행된 중견연구자지원사업 (NRF-2017R1A2B4006760)과 2017학년도 이화여자대학교 대학원 장학금 지원 (N.R. Choi)을 받아 작성되었습니다.
References
-
Akyüz, M., Ata, Ş., (2013), Seasonal variations of particle-associated nitrosamines by gas chromatography-mass spectrometry in the atmospheric environment of Zonguldak, Turkey, Environmental Science and Pollution Research, 20, p7398-7412.
[https://doi.org/10.1007/s11356-013-1758-y]

-
Alam, M.S., Keyte, I.J., Yin, J., Stark, C., Jones, A.M., Harrison, R.M., (2015), Diurnal variabililty of polycyclic aromatic compound (PAC) concentrations: Relationship with meteorological conditions and inferred sources, Atmospheric Environment, 122, p427-438.
[https://doi.org/10.1016/j.atmosenv.2015.09.050]

-
Albinet, A., Garziandia, E.L., Budzinski, H., Villenave, E., (2007), Polycyclic aromatic hydrocarbons (PAHs), nitrated PAHs and oxygenated PAHs in ambient air of the Marseilles area (South of France): Concentrations and sources, Science of the Total Environment, 384, p280-292.
[https://doi.org/10.1016/j.scitotenv.2007.04.028]

- Alves, C.A., Vicente, A.M., Custodio, D., Cerqueira, M., Nunes, T., Pio, C., Lucarelli, F., Calzolai, G., Nava, S., Diapouli, E., Eleftheriadis, K., Querol, X., Bandowe, B.A.M., (2017), Polycyclic aromatic hydrocarbons and their derivatives (nitro-PAHs, oxygented PAHs, and azaarenes) in PM2.5 from Southern European cities, Science of the Total Environment, 595, p494-504.
-
Aragón, M., Marcé, R.M., Borrull, F., (2013), Determination of N-nitrosamines and nicotine in air particulate matter samples by pressurised liquid extraction and gas chromatography-ion trap tandem mass spectrometry, Talanta, 115, p896-901.
[https://doi.org/10.1016/j.talanta.2013.07.010]

-
Bamford, H.A., Bezabeh, D.Z., Schantz, M.M., Wise, S.A., Baker, J.E., (2003), Determination and comparison of nitrated-polycyclic aromatic hydrocarbons measured in air and diesel particulate reference materials, Chemosphere, 50, p575-587.
[https://doi.org/10.1016/s0045-6535(02)00667-7]

-
Barrado, A.I., Garcia, S., Sevillano, M.L., Rodriguez, J.A., Barrado, E., (2013), Vapor-phase concentrations of PAHs and their derivatives determined in a large city: Correlations with their atmospheric aerosol concentrations, Chemosphere, 93, p1678-1684.
[https://doi.org/10.1016/j.chemosphere.2013.05.031]

-
Carter, W.P.L., (1994), Development of ozone reactivity scales for volatile orgnaic compounds, Journal of Air and Waste Management Association, 44, p881-899.
[https://doi.org/10.1080/1073161x.1994.10467290]

- Choi, N.R., Lee, S.P., Lee, J.Y., Jung, C.H., Kim, Y.P., (2016a), Speciation and source identification of organic compounds in PM10 over Seoul, South Korea, Chemosphere, 144, p1589-1596.
- Choi, N.R., Kim, Y.P., Ji, W.H., Hwang, G.-S., Ahn, Y.G., (2016b), Identification and quantification of seven volatile n-nitrosamines in cosmetics using gas chromatography/chemical ionization-mass spectrometry coupled with head space-solid phase microextraction, Talanta, 148, p69-74.
- Chuesaard, T., Chetiyanukornkul, T., Kameda, T., Hayakawa, K., Toriba, A., (2014), Influence of biomass burning on the levels of atmospheric polycyclic aromatic hydrocarbons and their nitro derivatives in Chiang Mai, Thailand, Aerosol and Air Quality Research, 14, p1247-1257.
- Dye, C., FjellsbØ, L.M.B., Dusinska, M., (2011), Nitramine analysis procedures development and screening toxicity study, Norwegian Institute for Air Research, Scientific Report (OR 15/2011).
-
Erupe, M.E., Price, D.J., Silva, P.J., Malloy, Q.G.J., Qi, L., Warren, B., Cocker Iii, D.R., (2008), Secondary organic aerosol formation from reaction of tertiary amines with nitrate radical, Atmosheric Chemistry and Physics Discussion, 8, p16585-16608.
[https://doi.org/10.5194/acpd-8-16585-2008]

- European Community (EC), (1993), Directive 93/11/EEC, http://eur-lex.europa.eu/legal-content/en/ALL/?uri=CELEX:31993L0011. Accessed on 2018.02.02.
-
Fajen, J.M., Carson, G.A., Roundehler, D.P., Vita, T.Y., Goff, U.E., Wolf, M.H., Edwards, G.S., Fine, D.H., (1979), N-nitrosamines in the rubber and tire industry, Science, 205, p1262-1264.
[https://doi.org/10.1126/science.472741]

-
Farren, N.J., Ramírez, N., Lee, J.D., Finessi, E., Lewis, A.C., Hamilton, J.F., (2015), Estimated exposure risks from carcinogenic nitrosamines in urban airborne particulate matter, Environmental science & technology, 49, p9648-9656.
[https://doi.org/10.1021/acs.est.5b01620]

- Fine, D., Rounbehler, D.P., Belcher, N., (1976), N-Nitroso compounds: detection in ambient air, Science, 192, p1328-1330.
- Fischer, C., Maurice, C., Lagerkvist, A., (1999), Gas emission from landfills. An overview of issues and research needs, Swedish Environmental Protection Agency, Stockholm, Sweden.
- Ge, X., Wexler, A.S., Clegg, S.L., (2011a), Atmospheric amines - Part I. A review, Atmospheric Environment, 45, p524-546.
- Ge, X., Wexler, A.S., Clegg, S.L., (2011b), Atmospheric amines-Part Ⅱ. Thermodynamic properties and gas/particle partitioning, Atmospheric Environment, 45, p561-577.
-
Grosjean, D., (1991), Atmospheric chemistry of toxic contaminants. 6. Nitrosamines: dialkyl nitrosamines and nitrosomorpholine, Journal of the Air & Waste Management Association, 41, p306-311.
[https://doi.org/10.1080/10473289.1991.10466847]

- Hernandez, B.S.V., Alvarez, V.M., Talavera, E.S., Munoz, O.A., Tovar, M.A.M., Pietrini, R.V., Ruiz, A.D.V., (2010), Temporal variation of nitro-polycyclic aromatic hydrocarbons in PM10 and PM2.5 collected in Northern Mexico City, Science of the Total Environment, 408, p5429-5438.
-
Hong, Y., Kim, K.H., Sang, B.-I., Kim, H., (2017), Simple quantification method for N-nitrosamines in atmospheric particulates based on facile pretreatment and GC-MS/MS, Environmental Pollution, 226, p324-334.
[https://doi.org/10.1016/j.envpol.2017.04.017]

-
Hutchings, J.W., Ervens, B., Straub, D., Herckes, P., (2010), N-nitrosodimethylamine occurrence, formation and cycling in clouds and fogs, Environmental science & technology, 44, p8128-8133.
[https://doi.org/10.1021/es101698q]

- International Agency for Research on Cancer (IARC), (2008), IARC monographs on the evaluation of carcinogenic risks to human, IARC, http://monographs.iarc.fr/ENG/Classification/. Accessed on 2017.09.13.
- Kim, S., Lee, G., Kim, K.-R., (2001), Measurements of Peroxyacetyl Nitrates at an Urban and a Rural Site in Korea, Journal of Korean Society for Atmospheric Environment, 17, p157-167, (in Korean with English abstract).
-
Lafontaine, S., Schrlau, J., Butler, J., Jia, Y., Harper, B., Harris, S., Bramer, L.M., Waters, K.M., Hardig, A., Simonich, S.L.M., (2015), Relative influence of tanspacific and regional atmospheric transport of PAHs in the Pacific Northwest, U.S., Environmental Science and Technology, 49, p13807-13816.
[https://doi.org/10.1021/acs.est.5b00800]

- Lee, D.Y., Wexler, A.S., (2013), Atmospheirc amines-PartⅢ: Photochemistry and toxicity, Atmospheric Environment, 71, p95-103.
- Lewtas, J., Nishioka, M., Peterson, B., (1990), Bioassay directed fractionation of the organic extract of SRM 1649 urban air particulate and ambient matter, International Journal of Environmental Analytical Chemistry, 39, p245-256.
- Li, W., Shen, G., Yuan, C., Wang, C., Shen, H., Jiang, H., Zhang, Y., Chen, Y., Su, S., Lin, N., Tao, S., (2016), The gas/particle partitioning of nitro- and oxy-polycyclic aromatic hydrocarbons in the atmsophere of northern China, Atmospheric Research, p172-173, 66-73.
-
Lindahl, S., Gundersen, C.B., Lundanes, E., (2014), A review of available analytical technologies for qualitative and quantitative determination of nitramines, Royal Society of Chemistry, 16, p1825-1840.
[https://doi.org/10.1039/c4em00095a]

-
Lindley, C.R.C., Calvert, J.C., Shaw, J.H., (1979), Rate studies of the reactions of the (CH3)N radical with O2, NO and NO2, Chemical Physics Letters, 67, p57-62.
[https://doi.org/10.1016/0009-2614(79)87105-5]

- Maguta, M.M., (2014), Environmental impact of amines emitted to the atmosphere, Disserattion for the degree of Philosophiae Doctor (PhD), Department of Chemistry, Faculty of Mathematics and Natural Sciences, University of Oslo, Norway (January, 2014).
-
Masuda, M., Mower, H.F., Brigitte, P., Celan, I., Friesen, M.D., Nishino, H., Ohshima, H., (2000), Formation of n-nitrosamines and n-nitramines by the reaction of secondary amines with peroxynitrite and other reactive nitrogen species: Comparison with nitrotyrosine formation, Chemical Research in Toxicology, 13, p301-308.
[https://doi.org/10.1021/tx990120o]

- Ministry of Food and Drug Safety (MFDS), (2013), Criteria for the equipment, containers and package (2013-246). Korea Ministry of Food and Drug Safety. (MFDS), http://www.lawnb.com/data/Focuslawdata/lawnbfocusB00029494540.pdf. Accessed on 2017.06.23 (Written in Korean).
- National Toxicology Program (NTP), (2016), 14th Report on Carcinogens (RoC), National Toxicology Program (NTP), US Department of Health and Human Services, https://ntp.niehs.nih.gov/pubhealth/roc/index-1.html. Accessed on 2017.07.20.
-
Nerín, C., Aznar, M., Carrizo, D., (2016), Food contamination during food process, Trends in Food Science & Technology, 48, p63-68.
[https://doi.org/10.1016/j.tifs.2015.12.004]

- Nielsen, C., D’Anna, B., Bossi, R., Bunkan, A.J.C., Dithmer, L., Glasius, M., Hallquist, M., Hansen, A.M.K., Luts, A., Salo, K., Maguta, M.M., Nguyen, Q., Mikoviny, T., Mueller, M., Skov, H., Sarrasin, E., Stenstrom, Y., Tang, Y., Westerlund, J., Wisthaler, A., (2012), Atmospheric Degradation of Amines (ADA)-Summary report from atmospheric chemistry studies of amines, nitrosaimes, nitramines and amides, CLIMIT prject no. 208122, University of Oslo, Norway.
-
Nielsen, C.J., D’Anna, B., Dye, C., Graus, M., Karl, M., King, S., Maguto, M.M., Mueller, M., Schmidbauer, N., Stenstrom, Y., Wisthaler, A., Pedersen, S., (2011), Atmospheric chemistry of 2-aminoethanol (MEA), Energy Porcedia, 4, p2245-2252.
[https://doi.org/10.1016/j.egypro.2011.02.113]

- Park, J., Lee, S.B., Kim, M.J., Kim, J.C., Lee, S.J., (2010), Analysis of PAHs and Nitro-PAHs in stationary emissions, Proceeding of the 50th Meeting of Korean Society for Atmospheric Environment, p427-428.
- Pitts, J.N., Grosjean, D., Cauwenberghe, K.V., Schmid, J.P., Dennis, R.F., (1976), Photooxidation of aliphatic amines under simulated atmospheric conditions: Formation o fnitrosamines, nitramines, amides, and photochemical oxidant, Environmental Science and Technology, 12, p946-953.
- Pliss, G.B., Zabezhinski, M.A., Petrov, A.S., Khudoley, V.V., (1982), Peculiarities of N-nitramines carcinogenic action, Arch Geschwulstjbrsch, 52, p629-634.
-
Ramírez, N., Ozel, M.Z., Lezis, A., Marce, R.M., Borrull, F., Hamilton, J.F., (2012), Determination of nicotine and n-nitrosamines in house dust by pressurized liquid extraction and comprehensive gas chromatography-nitrogen chemiluminiscence detection, Journal of Chromatography A, 1219, p180-187.
[https://doi.org/10.1016/j.chroma.2011.11.017]

-
Ringuet, J., Albinet, A., Garziandia, E.L., Budzinski, H., Villenave, E., (2012), Diurnal/nocturnal concnetrations and sources of particulate-bound PAHs, OPAHs and NPAHs at traffic and suburban sites in the region of Paris (France), Sience of the Total Environment, 437, p297-305.
[https://doi.org/10.1016/j.scitotenv.2012.07.072]

-
Scherf, H.R., Frei, E., Wiessler, M., (1989), Carcinogenic properties of N-nitrodimethylamine and N-nitromethylamine in the rat, Carcinogenesis, 10, p1977-1981.
[https://doi.org/10.1093/carcin/10.11.1977]

-
Sen, N., Seaman, S., Miles, W., (1976), Dimethylnitrosamine and nitrosopyrrolidine in fumes produced during the frying of bacon, Food and Cosmetics Toxicology, 14, p167-170.
[https://doi.org/10.1016/s0015-6264(76)80417-8]

-
Shapley, D., (1976), Nitrosamines: scientists on the trail of prime suspect in urban cancer, Science, 191, p268-270.
[https://doi.org/10.1126/science.191.4224.268]

- Simoneit, B.R.T., Rushdi, A.I., bin Abas, M.R., Didyk, B.M., (2002), lkyl amides and nitriles as novel tracers for biomass burning, Environmental Science & Technology, 37, p16-21.
-
Tang, N., Hattori, T., Taga, R., Igarashi, K., Yang, X., Tamura, K., Kakimoto, H., Mishukov, V.F., Toriba, A., Kizu, R., Hayakawa, K., (2005), Polycyclic aromatic hydrocarbons and nitropolycyclic aromatic hydrocarbons in urban air poarticulates and their relationship to emission sources in the Pan-Japan Sea countries, Atmopsheirc Environment, 39, p5817-5826.
[https://doi.org/10.1016/j.atmosenv.2005.06.018]

-
Tuazon, E.C., Atkinson, R., Aschmann, S.M., Arey, J., (1994), Kinetics and products of the gas-phase reactions of O3 with amines and related-compounds, Research on Chemical Intermediates, 20, p303-320.
[https://doi.org/10.1163/156856794x00351]

- U.S. Environmental Protection Agency (US EPA), (1972), Clean air act, United States Environmental Protection Agency (US EPA), https://www.epa.gov/lawsregulations/summary-clean-water-act. Accessed on 2017.06.23.
- U.S. Environmental Protection Agency (US EPA), (1976a), Resource Conservation and Recovery Act, United States Environmental Protection Agency (US EPA), https://www.epa.gov/laws-regulations/summary-resource-conservation-and-recovery-act. Accessed on 2017.06.23.
- U.S. Environmental Protection Agency (US EPA), (1976b), Toxic Substances Control Act. United States Environmental Protection Agency (US EPA), https://www.epa.gov/laws-regulations/summary-toxic-substances-control-act. Accessed on 2017.06.23.
- U.S. Environmental Protection Agency (US EPA), (1980), Comprehensive Environmental Response, Compensation, and Liability Act, United States Environmental Protection Agency (US EPA), https://www.epa.gov/laws-regulations/summary-compre-hensive-environmental-response-compensation-and-liability-act. Accessed on 2017.06.23.
- U.S. Food and Drug Administration (US FDA), (1984), CPG Sec. 500.450 Volatile N-Nitrosamines in Rubber Baby Bottle Nipples, United States Food and Drug Administration (US FDA), https://www.fda.gov/ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/ucm074418.htm. Accessed on 2017.06.23.
- World Health Organization (WHO), (2008), N-Nitrosodimethylamine in Drinking-water. World Health Organization (WHO), http://www.who.int/water_sanitation_health/dwq/chemicals/ndma_2add_feb2008.pdf. Accessed on 2017.06.23.
- Yu, M.S., Kim, C., Yang, S.B., Han, J.S., (2006), Measurement of Atmospheric Concentrations of Aliphatic Amine Compounds by GC/FTD, Korean Society of Odor Research and Engineering, 5, p237-244, (in Korean with English abstract).