Adsorption of Low-level CO2 using Activated Carbon Pellet with Glycine Metal Salt Impregnation
Copyright © 2014 Korean Society for Atmospheric Environment
The present study has evaluated the CO2 adsorption amount of activated carbon pellets (AC). Coconut shell based test AC were modified with surface impregnation of glycine, glycine metal salts and monoethanolamine for low level CO2 (3000 ppm) adsorption. Physical and chemical properties of prepared adsorbents were analyzed and the adsorbed amount of CO2 was investigated by using pure and 3,000 ppm CO2 levels. The impregnation of nitrogen functionalities was verified by XPS analysis. The adsorption capacity for pure CO2 gas was found to reach upto 3.08 mmol/g by AC-LiG (Activated carbon-Lithium glycinate), which has the largest specific surface area (1026.9 m2/g). As for low level CO2 flow the primary amine impregnated adsorbent showed 0.26 mmol/g of adsorption amount, indicating the highest selectivity. An adsorbent with potassium-glycine salts (AC-KG, Activated carbon-Potassium glycinate) instead of amine presented with 0.12 mmol/g of adsorption capacity, which was higher than that of raw activated carbon granules (0.016 mmol/g).
Keywords:
CO2 adsorption, Glycine, Alkali metal, Monoethanolamine, Activated carbon1. 서 론
최근 대도시 다중이용실내공간에 대한 공기질의 중요성과 더불어 관리규정이 강화되고 있다(Kim, 2009; Baek and Kim, 1998). 이 가운데 이산화탄소 역시 주요 관리대상 물질로 지정되어 있으며, 지하역사나 의료기관, 도서관, 실내주차장 등은 1,000 ppm 이하로 유지해야 한다. 대도시 지하철의 경우, 러시아워에는 객차 내부 이산화탄소 농도가 종종 최고 5,000 ppm 이상으로 상승하기도 한다(Lee and Jo, 2009; Park et al., 2005). 실내공간의 이산화탄소를 제어하는 기술에는 여러 가지가 있는데, 그 중 건식흡착공정은 요구되는 설비가 간단하고, 탈착을 통해 흡착제를 반복해서 사용할 수 있으므로 비용 및 유지관리 측면에서 적절한 기술로 판단된다(Jeon et al., 2004). 또한 흡착제의 개질을 통해 특정 기체분자만을 선택적으로 포집할 수 있기 때문에 낮은 운전비용과 더불어 분명한 장점으로 작용한다(Zou et al., 2002).
가스 포집공정에서 흡착제의 선정이 흡착성능을 결정하는 가장 중요한 요소이다. 따라서 약산성인 이산화탄소에 대한 흡착성능을 향상시키기 위해 흡착제의 유효흡착표면에 염기점을 부여하는 흡착제의 개질 및 개발에 관한 연구가 다양하게 진행되고 있다(Arenillas et al., 2005). 활성탄은 다공성의 탄소질 집합체로서 내부표면적이 우수하고, 비극성이라 상대적으로 수분의 영향이 크지 않으며, 물리∙화학적으로 안전성이 뛰어나 공기정화 및 용제회수 분야에도 널리 활용되고 있다 (Kang et al., 2007). 또한 활성탄의 발달된 미세공(micropore)이 표면에 노출되어 있어 VOC를 비롯한 기체분자에 대한 빠른 흡착속도 및 흡착용량을 향상시키는 반면, 이산화탄소에 대한 선택도는 낮은 편이다(Han et al., 2005).
높은 알칼리도에 의해 이산화탄소 분자와 빠르게 반응하는 1차 아민류인 모노에칠아민(MEA)은 연소공정 배가스 내 고농도 (>10 %) 이산화탄소 제거를 위한 흡수제로 널리 적용되고 있으며, 입자상 흡수제의 개질물질로 종종 사용되고 있다 (Jo et al., 2012; Song et al., 2009; Knowles et al., 2006; Gray et al., 2005; Kumar et al., 2003). 알칸올 아민류는 분자구조 내에 하이드록실기 (-OH)와 아미노기 (-NH2)를 동시에 가지고 있으며, 아미노기에 의해 염기성을 띠어 산성가스와 반응을 하지만 암모니아와 비슷한 강한 냄새가 나기 때문에 실내현장 적용 시 문제가 발생할 수 있다(Ahn et al., 2010).
한편, 아미노산은 알칸올 아민과 물리∙화학적 성질이 비슷하며, 산성가스와의 반응에 기인하는 아미노기와 카르복실기 (-COOH), 수소원자와 R (곁사슬)기 등이 결합된 α-탄소원자(α-carboxyl atom)를 갖는 것으로, R기의 종류에 따라 현재 20종의 표준 아미노산으로 구분되고 있다 (Mckee and McKee, 2004). 하지만 아미노산은 수용액상에서 카르복실기에 함유되어 있는 수소이온을 아미노기에 제공하면서 카르복실레이트 (-COO-)이온 형태로 존재하고, 아미노기는 H+이온은 제공받아 암모늄 (-NH3+)이온 형태로 ‘-’와 ‘+’의 성질을 동시에 지닌 양자화 (Zwitterion)된 상태로 존재하기 때문에 이산화탄소와 직접적으로 반응을 할 수 없다. Lim et al. (2012, 2011)은 이산화탄소 흡수시험에 있어 흡수제로 MEA와 Glycine을 비교, 평가하였으며, Glycine 수용액의 양자화된 아미노기를 활성화시키기 위해 등몰의 알칼리 금속을 첨가함으로써 짝염기 형태인 카르복실기가 Na+을 비롯한 금속이온으로 치환되고(-COONa), OH-가 짝산형태의 암모늄이온으로부터 양성자(H+)를 공여받아 탈수소화 됨으로써 아미노기로 활성화시켜 이산화탄소와의 직접적인 반응을 유도하였다 (Lim et al., 2012; Lim et al., 2011).
본 연구는 1차 아민과 아미노산의 한 종류인 글리신, 그리고 알칼리 금속염으로 치환한 글리신을 알칼리 공여물질로 선정하여, 상용 입자상 활성탄의 표면에 함침시킴으로써 실내공기 중 이산화탄소에 대한 선택도를 향상시키고자 하였다. 시험제조한 흡착제의 물성분석을 통해 흡착에 기여하는 물리, 화학적 특성을 관찰하였으며, 이산화탄소에 대해 흡착제가 지닌 최대 흡착능 및 저농도 이산화탄소에 대한 선택도를 평가하였다.
2. 실험장치 및 방법
2. 1 흡착제 제조 및 물성분석
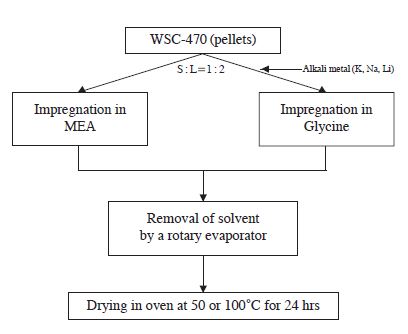
본 연구에서는 코코넛으로 만든 입자상 활성탄(WSC-470, Cargon)에 습식 함침법을 적용하여 시험용 흡착제를 제조하였다. 활성탄 입자의 표면 염기도 향상을 위하여 가장 기본적인 아미노산인 글리신과 글리신의 활성화를 위하여 알칼리 금속염 (NaOH, LiOH, KOH)을 선정하였으며, 사용된 시약은 국내 시약급 제품(대정화금(주))을 사용하였다. 또한 흡착능 평가를 위한 비교물질인 1차 아민(MEA, Monoethanolamine)은 일본(Yakuri pure chemicals co., Ltd) 시약급 제품을 사용하였다. 흡착제의 표면개질은 습식 함침법을 이용하였으며, 표면의 고른 염기점 향상과 제조시간 단축을 위하여 로터리 증발기로 감압 농축시켰다. 그림 1과 표 1은 흡착제 제조방법과 실험에 사용된 시약의 기본 물성 및 실험조건을 요약한 것이다. 각각의 조건에 대하여 시험제조한 시료는 글리신의 경우 AC-Gly로, 글리신 금속염의 경우 칼륨으로 치환된 흡착제의 글리신은 AC-KG, 리튬으로 치환된 흡착제의 글리신은 AC-LiG, 그리고 나트륨으로 치환된 흡착제의 글리신은 AC-NaG로 표기하였다. 1차 아민으로 개질한 시료의 경우 사전연구를 통해 가장 우수한 메탄올을 용매제로 이용한 AC-MM을 비교물질로 선정하였다. 첫 번째 M은 1차 아민인 MEA를 의미하며, 두 번째 M은 용매제로 사용한 메탄올(methanol)을 의미한다.
제조한 흡착제의 물리적 특성분석을 위하여 질소흡, 탈착법을 적용한 BET 측정기(BELSORP-mini II, Japan)를 통해, 비표면적 및 기공특성을 분석하였다. 또한 제조된 활성탄 표면의 조성변화는 XPS (Thermo Electron, K-Alpha)를 이용하였으며, 측정에 사용된 X선 광원은 Al K-α이며, 10-11 mbar의 압력조건에서 측정하였다. 또한 XPS는 X-선 광자에너지에 의해서 core level의 전자가 그 결합에너지 (binding energy)를 극복하고 나오는 광전자(photoelectron)의 운동에너지(kinetic energy)를 측정하여 분석하는 기술로, 운동에너지를 보정해주기 위해 289.68 eV를 C1s 피크로 정한 뒤 측정하였다(Kim et al., 2013).
2. 2 실험방법
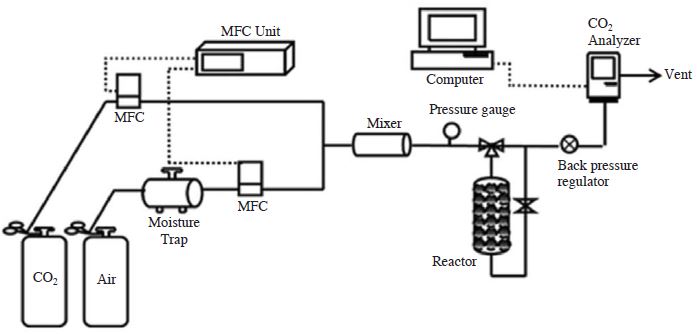
제조한 흡착제의 이산화탄소에 대한 흡착량은 2가지 방법에 의해 평가하였다. 흡착제가 가진 최대 흡착능을 확인하기 위하여 순수 이산화탄소(pure CO2, 99.99 %) 분위기에서 BET 분석장비를 이용하여 상온 및 0oC에서의 흡착용량을 측정하였다. 이때 BET 분석장비는 PSA (pressure swing adsorption) 방법으로 진공압력(P/Po=0)에서 상대압력 1기압(P/Po=1)으로 운전압력조건을 상승시키며 측정하게 된다. 이산화탄소에 대한 선택도 평가의 경우 저농도 3,000ppm(0.3 %, 혼합가스: Air) 분위기, 상압조건에서 이산화탄소에 대한 흡착량을 측정하기 위하여 그림 2와 같이 고정층반응기를 이용하였다. 가스 흐름은 상향 흐름이 되도록 구성하였으며, 내경 10mm(SUS)의 실린더형 반응기를 제작하여 5g의 흡착제를 충진한 다음 실험을 진행하였다. 또한 흡착 반응기 전단에 흡습용 실리카겔이 채워진 수분트랩을 설치함으로써 공급되는 공기 중의 수분을 제거하였다. 공급 가스의 총 유량은 0.7 L/min으로 MFC(MKP, TSC-110)를 이용하여 공급량 및 농도를 조절하였다. 흡착층을 통과한 이산화탄소의 농도는 전용 분석기(SenseAir, ASEN ALARM)를 이용하여 측정하였고, 측정된 데이터는 컴퓨터로 실시간 저장되었다. 이산화탄소 흡착량은 파과곡선(breakthrough curve)을 이용한 아래의 식에 의해 계산하였다.
이때 q는 몰 흡착량(mmol/g), Q는 반응기로 유입되는 가스 유량(L/min), w는 흡착제 질량(g), Ci와 C0는 흡착층 전∙후의 이산화탄소 농도 (ppm), 그리고 ts는 포화 흡착되기까지의 시간(min)을 나타낸다. 또한 단위환산을 위하여 운전조건(25oC, 1 atm)에서 이산화탄소 기체 1몰의 부피(24.4 l)에 대한 보정을 해주었다.
3. 결과 및 고찰
본 연구에서는 알칼리 금속염이 치환된 글리신염과 1차 아민으로 개질된 입자상 활성탄의 이산화탄소에 대한 포집정도를 평가하기 위하여 시험 흡착제의 기초물성을 고찰하였고, 제조된 흡착제의 최대 흡착능 및 저농도 이산화탄소에 대한 선택도를 비교, 분석하였다.
3. 1 흡착제의 특성분석
표 2는 기체성분 흡착에 있어서 가장 기본이 되는 물성으로 시험용 흡착제의 비표면적과 기공특성을 분석한 결과이다. 비표면적은 입자의 세공크기나 공극률에 따라 주로 결정되며, 기체성분의 선택적 흡착능과 밀접한 관계가 있다. 상용 입자상 활성탄(RAC)의 비표면적은 1,238.9 m2/g이며, 0.524 cm3/g의 기공부피를 가지고 있었다. 제조된 흡착제의 경우 RAC에 비해 비표면적 및 기공부피가 감소하며, 이는 함침물질인 글리신, 글리신염 및 MEA가 물리적 함침으로 인해 기공을 덮어 비표면적이 감소하는 것을 확인할 수 있다(Lu et al., 2010; Xu et al., 2005). 특히, 글리신으로만 개질한 활성탄인 AC-Gly보다 알칼리 금속이 함침된 글리신염의 경우 비표면적 및 기공부피가 감소하는 것을 확인할 수 있으며, 알칼리 금속종류에 따라서도 확연한 차이를 보였다. 이는 알칼리 금속의 분자량에 의한 것으로 분자량이 가장 낮은 Li로 치환된 AC-LiG가 1,026.9 m2/g, 0.447 cm3/g으로 세 종류의 글리신염이 함침된 활성탄 중 가장 큰비표면적 및 기공부피를 나타내었다. 전체 기공부피중 2 nm 이하의 미세기공이 차지하는 비율을 나타낸 FM/T의 경우 칼륨으로 치환된 글리신염을 함침한 AC-KG (91.5 %)의 경우를 제외하고는 상용 입자상 활성탄(88.1 %)보다 감소한 것을 확인할 수 있다. ACKG의 경우 다른 글리신염에 비해 분자량이 큰 칼륨글리신염이 큰 세공을 채워 전체 기공부피는 감소하는 반면 미세공의 비율이 증가한 것으로 사료된다. 이는 미세기공의 비율 증가로 세공크기 또한 RAC와 다른 시험제조 활성탄보다 감소하는 것을 확인할 수 있었다.
IUPAC 정의에 의하면 20 Å 즉, 2 nm 이하를 미세기공 (micropore)으로 분류하고 있으며, 이산화탄소분자에 대한 실질적인 흡착현상이 이루어지는 영역으로 흡착에 있어 비표면적과 함께 중요한 흡착점으로 기인할 것으로 사료된다 (Thompson and Dyer, 1985).
표 3은 흡착제의 표면 염기도 변화를 분석하기 위한 XPS 측정 결과이다. RAC의 경우 0.6 wt.%의 낮은 질소 함량을 보인 반면, 표면개질한 흡착제 모두 질소 비율이 증가한 것을 확인할 수 있었다. 특히, 글리신으로 처리한 AC-Gly의 경우 가장 많은 질소 함량을 확인할 수 있다. 이는 알칼리 금속으로 치환된 글리신의 경우 식 (1)과 같이 글리신과 알칼리 금속이 1 : 1 반응으로, 글리신으로만 개질한 활성탄 표면의 아미노기만 상대적으로 우수해 질소 함량이 더 높게 나타난 것으로 사료된다 (Lim et al., 2011; Kumar et al., 2003; Mathonat et al., 1997).
비교물질로 선정한 AC-MM의 경우 2.8 wt.%로 상당히 높은 질소 함량을 보였고, 이는 표 2의 BET결과에서 나타났듯이 활성탄에 MEA가 많이 함침되었기 때문에 질소 함량이 높고, 비표면적도 크게 감소한 것으로 사료된다.
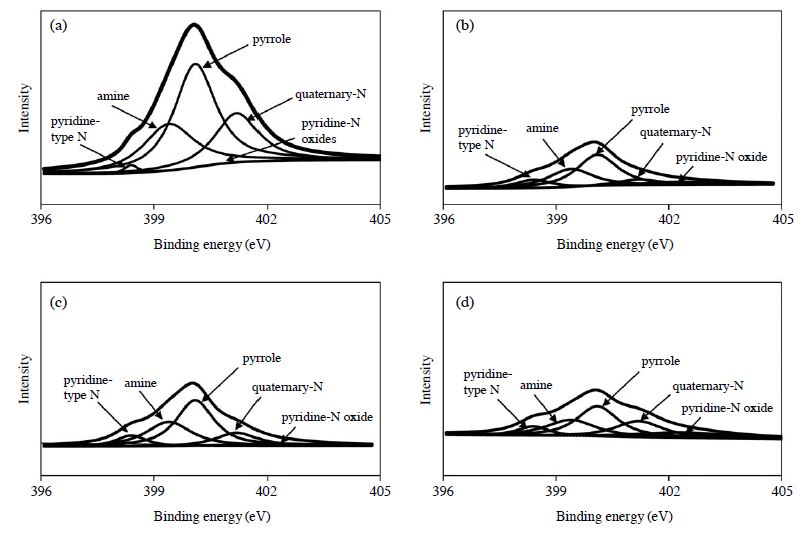
그림 3은 표면 염기도 향상에 있어 주요 역할을 하는 질소 작용기(N1s, 396~405 eV 구간)의 정량적 분석을 위하여 wide scanning spectrum으로 분석하여 결합에너지와 강도를 나타낸 것이다. 개질 흡착제의 파형 분리결과, pyridine-type N (BE=398.4), amine(BE=399.4), pyrrole (BE=400.1), quaternary-N (BE=401.2), pyridine-N oxides (BE=402.4)와 같은 질소를 포함한 작용기가 지지체인 활성탄 입자 표면에 형성된 것을 확인할 수 있었다 (Biniak et al., 1997). 또한 표 3의 질소원소에 대한 정성적 분석에서와 같이 5가지의 질소를 포함한 작용기의 면적을 정량적으로 계산한 결과, AC-MM (10648.8)>AC-NaG (4651.3)>AC-LiG (4351.4)>AC-KG (3509.3) 순으로 나타났다. 이와 같이 루이스 염기점을 갖는 작용기를 활성탄 표면에 도입함으로써 약산성인 이산화탄소와의 산-염기 반응을 유도하여, 이산화탄소 분자에 대한 선택도를 향상시키는 중요한 화학적 흡착점으로 작용할 것으로 사료된다.
3. 2 이산화탄소의 흡착능 평가
본 연구는 상용 입자상 활성탄(RAC)과 알칼리 물질로 개질된 활성탄이 가진 최대 흡착능 (순수 이산화탄소, 0oC & 25oC, P/Po=1)과 3,000 ppm의 저농도 이산화탄소에 대한 선택도를 평가하였다.
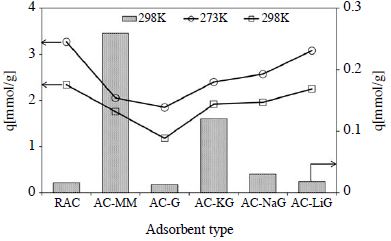
그림 4는 흡착제별 최대 흡착능을 확인하기 위하여 BET 분석기를 이용하여 순수 이산화탄소에 대한 흡착량을 꺾은선 그래프 (○: 273 K, □: 298 K)로 나타내었다. 이때 흡착량의 경우 흡착시험의 최대 압력조건인 상대압력 1일 때의 최종 흡착량을 나타낸 것이다. 0oC 분위기에서는 비표면적이 가장 우수한 상용 입자상 활성탄 (RAC)이 3.27 mmol/g (상온 분위기: 2.34 mmol/g)으로 가장 높은 이산화탄소 흡착량을 보여주었다. MEA와 글리신, 알칼리 금속이 치환된 글리신염으로 개질한 활성탄 모두 RAC보다 두온도 범위에서 낮은 흡착량을 보였으며, 이는 물리적 흡착점으로 작용한 비표면적 및 세공부피의 감소로 인해 물리적 흡착량이 감소한 것으로 사료된다. 즉, 제조된 흡착제 중 비표면적 및 세공부피가 우수한 AC-LiG가 3.08 mmol/g (0oC 분위기 & 상온 분위기: 2.25 mmol/g)의 높은 흡착량을 보였다. AC-G의 경우 RAC 다음으로 우수한 물성을 가졌음에도 불구하고, 낮은 흡착량을 보인 것은 함침된 글리신의 질소가 이산화탄소 흡착을 위한 활성화가 이루어지지 않은 상태에서 미세기공을 채움으로써 미세기공이 차지하는 비율(86.9 %)이 낮아졌기 때문에 흡착량이 상대적으로 감소한 것으로 판단된다. AC-MM의 경우 함침물질에 의해 비표면적 및 세공부피의 감소, 낮은 미세기공의 비율로 인해 1.76 mmol/g (0oC 및 상온 분위기: 2.05 mmol/g)의 낮은 흡착량을 보였다. 즉, 비표면적 및 세공부피뿐만 아니라 미세기공은 기체분자의 침투와 확산에 매우 중요한 역할인 이산화탄소 분자와의 효과적인 물질전달에 기여함으로써 흡착효율을 결정하는 주요 요소이다 (Lim et al., 2013; Diaz et al., 2008). 또한, 온도에 따른 흡착량을 비교한 결과, RAC 및 개질한 흡착제 모두 상온보다 저온인 0oC 분위기에서 높은 흡착량을 보였으며, 이는 발열반응인 흡착 공정이 온도상승 시 가스 성분의 물리적 흡착을 저해하기 때문에 저온 분위기일수록 흡착량이 증가하는 것으로 사료된다(Kim et al., 2010; Beruto et al., 1984).
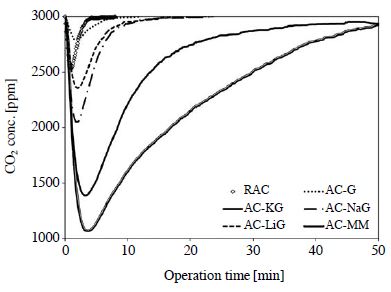
그림 4의 막대그래프와 그림 5의 파과곡선은 3,000ppm의 이산화탄소 흐름에 대한 흡착량을 나타낸 것으로서 RAC의 경우, 우수한 비표면적에도 불구하고, 0.016 mmol/g으로 이산화탄소에 대한 선택도가 매우 낮은 편이다. 이는 앞서 언급한 바와 같이 약 산성가스에 해당되는 이산화탄소에 대한 친화력이 낮은 것으로, XPS 결과에서도 확인한 바, 표면 질소 함량이 0.6 wt.%로 표면 염기도 낮기 때문이다. 1차 아민으로 개질한 AC-MM의 경우 높은 표면 질소 함량과 비례하여, 이산화탄소에 대한 선택도가 매우 우수한 것으로 나타났다. 즉, 흡착제 단위 무게당 0.26 mmol으로 RAC에 비해 15 % 이상 흡착량이 향상된 것을 확인할 수 있었다. 알칼리 금속염이 치환된 글리신으로 개질한 활성탄 또한 표면 염기점 상승으로 인해 흡착량이 AC-KG의 경우 0.12 mmol/g (6.5 %), AC-NaG의 경우 0.03 mmol/g, 그리고 AC-LiG의 경우 0.018 mmol/g으로 흡착량이 증가한 것을 볼 수 있다. 글리신으로 함침한 AC-Gly의 경우 RAC보다 낮은 0.013 mmol/g의 흡착량을 보였으며, 이는 표면의 우수한 질소 함량(3.6 wt.%)에도 불구하고, 질소 작용기인 아미노기가 활성화되지 않고 단순히 기공을 차단하는 작용만하였기 때문에 물리적 성질(비표면적, 세공부피, 미세기공 비율) 저하로 인해 상용 활성탄보다 낮은 선택도를 보인 것으로 사료된다. 즉, 표면 염기도 향상은 화학적 흡착에 관여한 것으로 저농도 이산화탄소에 대한 선택도를 높이며, 표면 질소 함량이 비슷한 경우, 물리적 흡착에 주요 착안점이 되는 미세기공의 비율이 높을수록 흡착량이 향상되는 것을 확인할 수 있었다(Lim et al., 2013).
4. 결 론
실내환경중에서 발생할 수 있는 저농도 이산화탄소에 대한 선택적 분리, 포집능을 향상시키기 위하여 알칼리 수용액(MEA, Glycine, Glycine Metal Salts)으로 활성탄 펠렛의 표면을 개질하였다. 습식 함침법으로 질소 작용기를 형성시킨 활성탄 흡착제는 비표면적 및 공극률이 감소함에 따라 순수 기체상 이산화탄소 분위기(100 %)에서의 물리적 흡착량은 초기 활성탄보다 감소하였으나, 표면 염기도 향상에 의해 복합가스 흐름인 저농도 이산화탄소 (3000 ppm)에 대한 선택적 흡착량은 15 % 이상 향상되었다. 아민에 비하여 상대적으로 유해성이 낮은 아미노산 염을 함침하면 약 6.5%의 흡착량 향상을 얻을 수 있었다. 아민또는 아미노산 수용액으로부터 얻어지는 표면질소작용기는 pyridine-type N, amine, pyrrole, quaternary-N, pyridine-N oxides 등으로 XPS 결과 확인되었으며, 이러한 알칼리 작용기가 약산성인 이산화탄소의 산-염기 반응을 촉진하여 선택적 포집능을 향상시킬 수 있는 가능성을 확인하였다.
Acknowledgments
이 논문은 2012년 정부(교육과학기술부)의 재원으로 한국연구재단「실내공기질 개선을 위한 저농도 CO2 흡착선택도 향상 연구」의 지원을 받아 수행된 기초연구사업입니다(2012-0002485).
References
-
Ahn, S.Y., H.J. Song, J.W. Park, J.H. Lee, I.Y. Lee, K.R. Jang, Characterization of metal corrosion by aqueous amino acid salts for the capture of CO2, Korean J. Chem. Eng, (2010), 27(5), p1576-1580.
[https://doi.org/10.1007/s11814-010-0246-z]

-
Arenillas, A., K.M. Smith, T.C. Drage, C.E. Snape, CO2 capture using some fly ash-derived carbon materials, Fuel, (2005), 84, p2204-2210.
[https://doi.org/10.1016/j.fuel.2005.04.003]

- Baek, S.O., Y.S. Kim, Characterization of Air Quality in Various Types of Indoor Environments in Urban Areas - Focusing on Homes, Offices, and Restaurants, J. KAPRA, (1998), 14(4), p343-360.
-
Beruto, D., R. Botter, A.W. Searcy, Thermodynamics and kinetics of carbon dioxide chemisorption on calcium oxide, J. Phys. Chem, (1984), 88(18), p4052-4055.
[https://doi.org/10.1021/j150662a039]

-
Biniak, S., G. Szyma´nski, J. Siedlewski, A. ´Swiakowski, The characterization of activated carbons with oxygen and nitrogen surface groups, Carbon, (1997), 35(12), p1799-1810.
[https://doi.org/10.1016/S0008-6223(97)00096-1]

-
Diaz, E., E. Munoz, A. Vega, S. Ordonez, Enhancement of the CO2 retention capacity of Y zeolites by Na and Cs treatments: effect of adsorption temperature and water treatment, Ind. Eng. Chem. Res, (2008), 47(2), p412-418.
[https://doi.org/10.1021/ie070685c]

-
Gray, M.L., Y. Soong, K.J. Champagne, H. Pennline, J.P. Baltrus, R.W. Stevens Jr, R. Khatri, S.S.C. Chuang, T. Filburn, Improved Immobilized Carbon Dioxide Capture Sorbents, Fuel Processing Technology, (2005), 86(14-15), p1449-1455.
[https://doi.org/10.1016/j.fuproc.2005.01.005]

- Han, J.U., D.J. Kim, M. Kang, J.W. Kim, J.M. Kim, J.E. Yie, Study of CO2 Adsorption Characteristics on Acid Treated and LiOH Impregnated Activated Carbons, J. Korean Ind. Eng. Chem, (2005), 16(3), p312-136.
- Jeon, J.K., Y.K. Park, K. Chue, Study of PSA process for carbon dioxide recovery over zeolite adsorbent: Effect of rinse rate on process performance J, Korean Soc. Atmos. Environ, (2004), 220(1), p99-110.
-
Jo, D.H., K.S. Cho, C.G. Park, S.H. Kim, Effects of Inorganic-organic Additives on CO2 Adsorption of Activated Carbon, Korean Chem. Eng. Res, (2012), 50(5), p885-889.
[https://doi.org/10.9713/kcer.2012.50.5.885]

-
Kang, K.H., S.K. Kam, S.W. Lee, M.G. Lee, Adsorption characteristics of activated carbon prepared from waste citrus peels by NaOH activation, J. Environ. Sci, (2007), 16(11), p1279-1285.
[https://doi.org/10.5322/JES.2007.16.11.1279]

- Kim, K.H., Y.H. Lim, Y.M. Jo, Adsorption Isotherm of Low Level Carbon Dioxide in Indoor Air, J. Korean Soc. Indoor Environ, (2010), 7(2), p113-126.
- Kim, J.M., Status and prospect of carbon dioxide storage technologies, KIC News, (2009), 12(2), p31-41.
-
Kim, M.J., S.H. Chung, M.S. Lee, D.W. Lee, K.Y. Lee, Catalytic Nitrate Reduction in Water over Mesoporous Silica Supported Pd-Cu Catalysts, Clean Technology, (2013), 19(1), p65-72.
[https://doi.org/10.7464/ksct.2013.19.1.065]

-
Knowles, G.P., S.W. Delaney, A.L. Chaffee, Diethylenetriamnie [propyl (silyl)]-Functionalized (DT) Mesoporous Silicaes as CO2 Adsorbents, Ind. Eng. Chem. Res, (2006), 45, p2626-2633.
[https://doi.org/10.1021/ie050589g]

-
Kumar, P.S., J.A. Hogendoorn, G.F. Versteeg, P.H.M. Feron, Kinetics of the reaction of CO2 with aqueous potassium salt of taurine and glycine, AlChE Journal, (2003), 49(1), p203-213.
[https://doi.org/10.1002/aic.690490118]

-
Lee, K.M., Y.M. Jo, Ambient adsorption of low level carbon dioxide by metal treated activated carbon, J. Korean Soc. Atmos. Environ, (2009), 25(4), p316-324.
[https://doi.org/10.5572/KOSAE.2009.25.4.316]

- Lim, Y.H., Y.K. Park, Y.M. Jo, Characterization of Glycine Metal Salts for CO2 Absorption, Appl. Chem. Eng, (2012), 23(3), p284-288.
- Lim, Y.H., Y.M. Jo, J.S. Park, CO2 Absorption by Alkali-modified Amino Acid Salts, Appl. Chem. Eng, (2011), 22(5), p526-531.
-
Lim, Y.H., Y.M. Jo, S.H. Kim, Adsorption of Carbon Dioxide using Pelletized AC with Amine impregnation, Journal of the Korean Oil Chemists’ Society, (2013), 30(1), p88-95.
[https://doi.org/10.12925/jkocs.2013.30.1.088]

-
Lu, C., H. Bai, F. Su, W. Chen, J.F. Hwang, H.H. Lee, Adsorption of Carbon Dioxide from Gas Streams via Mesoporous Spherical-Silica Particles, J. Air & Waste Manage. Assoc, (2010), 60(4), p489-496.
[https://doi.org/10.3155/1047-3289.60.4.489]

-
Mathonat, C., V. Majer, A.E. Mather, J.P.E. Grolier, Enthalpies of absorption and solubility of CO2 in aqueous solutions of methyldiethanolamine, Fluid Phase Equilibria, (1997), 140(1-2), p171-182.
[https://doi.org/10.1016/S0378-3812(97)00182-9]

- McKee, T., J.R. McKee, Biochemistry, (2004), 3/E, p80, Life Science Publishing Co.
- Park, J.M., Y.H. Park, S.H. Yi, J.I. Park, Temperature Compensation of NDIR CO2 Gas Sensor, Proceeding of the KIEEME Annual Summer Conference, (2005), 6, p81-82.
- Song, H.J., S.M. Lee, J.H. Lee, J.W. Park, K.R. Jang, J.G. Shim, J.H. Kim, Absorption of Carbon Dioxide into Aqueous Potassium Salt of Serine, J. Kor. Soc. Environ. Eng, (2009), 31(7), p505-514.
-
Thompson, R.W., A. Dyer, Nucleation of zeolite Na-A crystals in hydrothermal systems, Zeolites, (1985), 5, p302-308.
[https://doi.org/10.1016/0144-2449(85)90162-9]

-
Xu, X., C. Song, B.G. Miller, A.W. Scaroni, Adsorption separation of carbon dioxide from flue gas of natural gas-fired boiler by a novel nanoporous “molecular basket” adsorbent, Fuel Processing Technology, (2005), 86(14-15), p1457-1472.
[https://doi.org/10.1016/j.fuproc.2005.01.002]

-
Zou, Y., M. Vera, A.E. Rodrigues, Adsorption of Carbon Dioxide at High Temperature-a Review, Separation and Purification Technology, Separation and Purification Technology, (2002), 26(2/3), p195-205.
[https://doi.org/10.1016/S1383-5866(01)00165-4]