A Study of Analytical Method for Ethylene and Low Weight Hydrocarbons (LWHC) using Thermal Desorption and Gas Chromatography-Flame Ionization Detector with (TD-GC-FID)
Copyright © 2014 Korean Society for Atmospheric Environment
In this study, an experimental approach to measure a suite of low weight hydrocarbons was investigated with an emphasis on ethylene (EL) along with many others (ethane (EA), propane (PA), propylene (PL), n-butane (BA), acetylene (AL), methyl acetylene (ML)). Their concentrations were quantified using GC-FID system equipped with thermal desorption (TD) system. The TD-based analysis was conducted using both Link Tube/Thermal Desorber (LT/TD) method and Modified Injection through a Thermal Desorption (MITD) method. The results of these analyses were evaluated in a number of respects. The system allowed the detection of all compounds except methane with the mean response factor (RF) of 10.28 (EA) to 11.94 (PL). The method detection limits of target compounds were seen in the range of 0.027 (ML) to 0.146 ng (BA). The emission flux of some environmental samples (fruits), when measured using a small flux chamber system, fell in the range of 0.14 (AL: Kiwi) to 181 ng∙g-1∙hr-1 (EL: Apple Peel). The results of this study confirm that the experimental approach developed in this study allows to accurately measure emissions of low weight hydrocarbons (LWHC) like ethylene from various natural and man-made source processes.
Keywords:
Ethylene, LWHC (Low weight hydrocarbon), FID (Flame Ionization Detector), TD (Thermal Desorption), Flux1. 서론
Ethylene은 식물의 성장, 노화, 숙성 등에 관한 식물 호르몬에 많은 영향을 주는 성분이다 (Abeles et al., 1992). 대표적으로 사과, 포도, 바나나 등과 같은 과일이 숙성하는 시기에 과일 표면에서 많이 발생하기 때문에, Ethylene의 발생 유무는 과일의 숙성단계를 평가 및 판단하는 중요한 역할을 한다. 실제 수확기를 거친 과일은 출고 전까지 저장소에서 보관하는데, 이때 보관장소의 온도나 기간 등에 따라 Ethylene의 발생량이 변화한다(Lim et al., 2009). 오랜 기간 보관시 Ethylene의 발생을 체계적으로 관리하지 않을 경우, 과일의 조기노화로 인한 상품가치의 손실이 일어날 수 있다.
과일의 노화를 억지하기 위해, Ethylene의 발생률을 저하하는 1-Methylcyclopropene (1-MCP)과 같은 물질을 사용하는 사례도 많이 알려졌다(Oh et al., 2007). 그 외에도 Ethylene을 제거하기 위한 방법들을 찾기 위해, 많은 연구자가 다양한 연구를 진행하고 있다. 이들의 중요성을 고려할 때, 일반적으로 많은 연구의 대상이 되는 방향족성분과 마찬가지로 Ethylene과 같은 저분자량의 탄화수소성분들에 대해서도 극미량 농도대부터 고농도범위의 시료에까지 다양한 정도관리체계의 구축과 응용에 대한 연구가 필요한 시점이다. 예를 들어, 사과를 저온보관했을 때, Ethylene은 사과 100 g에서 1시간 동안 1 L 정도의 시료를 채취할 경우, 대략 50 ppb 수준의 매우 미미한 수준으로 발생한다(Lim et al., 2009). 이와 같은, 저농도의 저분자 탄화수소 (Low weight hydrocarbon: LWHC) 분석하기 위해서는 기술적으로 안정적인 저농도 분석기법의 개발과 그에 대한 체계적 공정이 필요하다.
이를 위해, Gas Chromatography와 Flame Ionization Detector (GC-FID)분석 시스텝에 저온열탈착기(Thermal Desorption: TD)를 결합한 분석방식을 기반으로 LWHC의 분석기술을 도출하고자 하였다. 이를 위해, 본 연구에서는 TD에 고체흡착관 대신 bag 방식으로 채취한 시료를 Link Tube (LT)를 장착한 LT/TD 전처리 방식에 기반을 둔 분석기법을 연구하였다 (Kim and Kim, 2012). LT/TD방식의 장점으로는 시료를 바로 열탈착 단계의 최후반부에 공급하므로서, Sorbent Tube (ST)와 같이 선행농축단계에서 발생 가능한 여러 가지 문제점을 보완할 수 있다. 특히, 저온 상태에서 Ethylene과 같은 저분자 성분의 시료 흡착이 불가능한 점과 ST사용에 의한 시료의 손실이 일어나는 문제를 대부분 보완할 수 있다(Kim and Kim, 2012). LT/TD분석방법은 ST/TD의 보완 분석방식으로 이미 본 연구진의 선행연구에서 자세하게 소개한 바 있다. 본 연구에서는 LT/TD시스템을 이용한(LWHC의) 저농도 표준시료를 직접 주입하는 방식을 주기준분석 방식으로 적용하면서, 고농도 표준시료를 TD로 분석 할 수 있는 변형주입(Modified Injection through a TD: MITD) 방식을 보조분석기술로 활용하였다. 이를 토대로 동일 시스템에서 다양한 농도대의 Ethylene을 포함하는 LWHC를 동시에 분석할 수 있는 분석기법을 연구하였다. 또한, LWHC의 기본적인 정도관리 및 여러 가지의 과일 시료에 대한 발생특성을 조사하였다.
2. 연구 방법
2. 1 Ethylene 시료준비 및 조제방법
본 연구에서는 Ethylene (EL) 및 LWHC의 분석방법에 대한 검량정보와 정도관리 (Quality Assurance/ Quality control: QA/QC) 자료를 확보하기 위해, 표 1에 제시한 바와 같이 EL과 동시에 참고성분으로 Methane (MA), Ethane (EA), Propane (PA), Propylene (PL), n-Butane (BA), Acetylene (AL), Methyl acetylene (ML)을 포함하는 다양한 LWHC들을 동시에 포함하는 표준시료를 구매하였다(23470-U, Supelco, Korea). EL과 기타 비교 성분들을 포함한 원표준시료로부터 검량자료를 확보하기 위하여, 다음과 같이 작업용 표준시료 (working standard: WS)를 희석조제하였다. 원 표준시료는 Polyester aluminum bag (PEA bag; TOP Trading Eng., Korea)을 이용하여 초고순도 질소(N2, 99.999% 이상)로 희석하는 방식으로 검량분석할 WS 를 두 가지 주입방법의 농도대 기준으로 조제하였다.
우선 LT/TD방식으로 분석할 저농도대 (10 ppb)를 포함하는 시료를 다음과 같이 10, 100, 1,000 ppb의 3가지 농도대로 조제하였다(표 2). 또한, MITD방식으로 분석할 상대적으로 고농도 중심의 작업용 표준시료를 100, 200, 500, 1,000 ppb의 4가지 농도대로 준비 하였다(표 3). 표 1에는 이들 표준시료의 분석을 통해 확보한 기본적인 정도관리 변수(검출한계(MDL), 재현성(relative standard error: RSE))정보를 추가로 제시 하였다.
기체상 표준시료를 통해 EL을 포함 총 7가지의 LWHC들에 대한 외부검량(external Calibration) 자료를 확보하였다. 환경시료로부터 에틸렌의 분석자료를 도출하기 위하여, 네 가지의 과일을 이용하여 과일의 부위별로 다음과 같이 총 7가지의 다양한 시료들을 확보하였다: (1) 사과 껍질, (2) 사과 알맹이, (3) 부패한 사과, (4) 딸기, (5) 키위 껍질, (6) 키위 알맹이, (7) 토마토, 이들 시료별로 무게가 10.0~10.9 g으로 준비하였다. 사과와 키위의 경우, 껍질을 제거한 후 껍질과 알맹이로 나누어 측정하였다. 나머지 시료들은 껍질을 제거하지 않고 원상태 그대로 시료로 사용하였다. 각각의 시료들에 대한 약식 코드 및 무게 등에 대한 자세한 정보를 표 4에 제시하였다.
확보한 과일 시료들은 임핀저를 변형한 소형동적챔버 (Mini-dynamic flux chamner)방식을 적용하여, LWHC의 flux를 정량할 수 있는 시료채취용 platform으로 활용하였다 (그림 1). 약 750 mL 부피용량의 임핀저 안에 준비한 개별시료를 넣고 전단에 고순도 공기 실린더와 후단에 1 L PEA bag을 연결해 주었다. 고순도 공기를 일정한 유속(50mL∙min-1)으로 임핀저에 주입한 후, 그 내부로부터 흘러나오는 시료를 다음과 같은 주기로 채취하였다(그림 1). 이때 sweep용으로 흘려주는 gas는 처음 5분간 bypass를 시킨 후, 20분간 1L의 시료를 채취하였다.
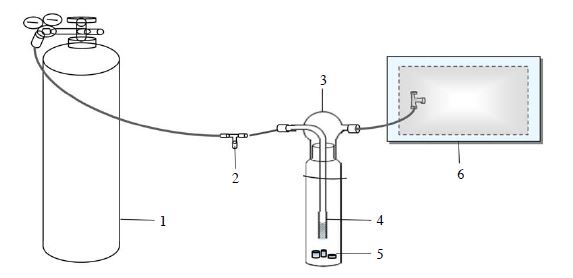
Illustration of a mini-flux chamber system made of an impinger system.1. Ultra pure air (99.999%) 2. N2 flow regulator 3. Impinger bottle 4. Glass tubing with a bubbler tip to evenly distribute the diluent gas 5. Fruit samples 6. 1 L polyester aluminum bag (Collect gas samples from food samples)
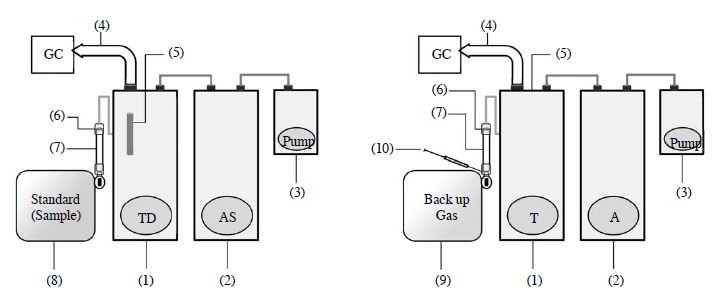
Illustration of the thermal desorption analysis for gaseous standard sample of ethylene and LWHC using LT/TD and MITD method.(1) Thermal desorber (Unity, Markes, UK) (2) Air server (UNITY, Markes, UK) (3) Mini-Vacuum pump (4) Transfer line (5) Link tube (6) Silicone tube (7) Quartz trap (8) Gaseous standard sample in polyester aluminum bag (1 L) (9) N2 gas in polyester aluminum bag for back-up (1 L) (10) 10 mL syringe for sample gas
2. 2 Ethylene의 분석 방법
본 연구에서는 기체상 EL을 분석하기 위해, Gas Chromatography (GC)-Flame Ionization Detector (FID)분석 장비를 사용하였다. 저농도 시료의 분석에 용이한 Thermal Desorption (TD)에 시료 주입 시, 여러 조건을 추가할 수 있는 LT를 연계하는 방법으로 시료의 저온농축을 진행하였다(그림 2). TD 내부에 저온 농축관(Cold Trap)은 EL을 잘 흡착할 수 있도록 Carbopack B와 Carboxen 1000을 2 : 3 부피 비로 혼합하였다. Cold Trap의 온도는 -15oC를 유지하였다. 저온농축을 유도한 후, Cold Trap은 다시 250oC로 5분간 열탈착하여 시료를 GC로 이동하였다. 이때, TD에서 시료를 GC로 옮길 때 Splitless 상태로 설정하였다. 그리고 Carrier gas로 고순도 N2 (99.999%)를 사용하였다. EL을 포함한 LWHC들은 일반적인 VOC(예를 들어, BTX)와 같이 보편적인 FID분석방식으로 Column에 의한 분리가 어렵다는 점을 감안하여, 저분자성분의 분리에 특화한 Plot column (diameter: 0.32 mm, Length: 50 m, film thickness: 5mm)을 사용하였다. CG 의 Oven은 40oC로 1분, 20oC min-1으로 190oC까지 승온 후 1.5분을 유지하는 방식으로, 총 10분의 분석 주기로 설정하였다. Column을 통과한 시료는 최종적으로 FID로 검출이 이루어졌다(표 5).
표준시료를 주입하여 검량자료를 확보하는 부분은 앞서 언급한 바와 같이 두 가지 방법을 적용하였다. 첫 번째 방법은 LT/TD방식으로 MFC (Mass Flow controller)를 이용하여 일정한 양의 표준시료를 LT로 바로 주입하여 TD로 통과시킨다. 이러한 분석기술은 기본적으로 TD에 곧바로 시료의 저온농축을 유도하여, ST채취화 같은 단계를 거치지 않고 GC로 분석하는 방법이다. 두 번째 방법은 MITD방식에 기반을 둔 변형주입방법으로 LT/TD방식과 달리 Back up gas(N2, 99.999%)를 흘려주는 조건에서 소량의 고농도시료를 LT의 연결 선상에 주사기를 이용하여 직접 주사 주입하는 방식이다. 주사기를 이용하여 10 mL 이하의 시료를 LT 상으로 직접 주사한 후 이를 TD로 통과시켜 저온농축을 유도하여 분석에 적용한다. 이와 같이 LT/TD방식에 기반을 둔 분석법은 비교적 저농도 시료를 대량으로 TD분석할 때, 그리고 이에 반해 MITD방식은 상대적으로 고농도의 시료를 소량으로 분석할 때 용이한 방법이다.
3. 결과 및 토의
3. 1 분석 결과 비교
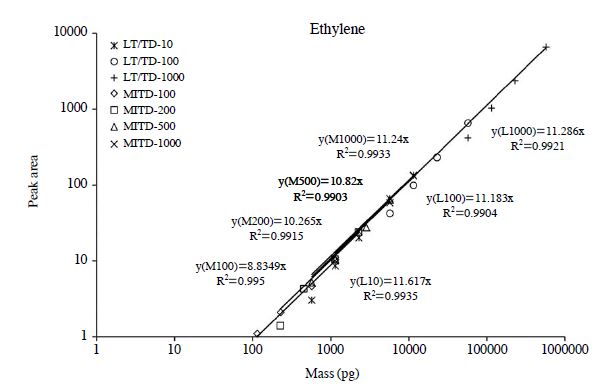
본 연구는 두 가지 시료 주입 방법으로 넓은 농도 범위대에서 존재하는 EL을 안정적으로 분석하기 위해 (1) LT/TD방식은 최대 1,000배 차이의 농도범위대(0.57~572 ng: 표 2) 그리고 (2) MITD방식은 최대 100배 차이의 농도범위대(0.11~11.4 ng: 표 3)로 표준시료를 조제하여 검량하였다. 그리고 이를 통해, 여러 농도대의 감응계수 (Response Factor: RF)와 직선성 결정계수(Coefficient of determination: R2)값을 산출하였다(표 6). 본 연구의 대표성분인 EL을 중심으로 결과를 살펴보면, LT/TD방식의 3가지 농도대(10, 100, 1000 ppb)에서 EL의 RF는 11.62, 11.18, 11.29로 비슷한 값이 나타나는 것을 확인하였다, 그리고 R2은 0.9935, 0.9904, 0.9921으로 높은 재현성을 확인하였다. MITD방식의 4가지 농도대 (100, 200, 500, 1000ppb)에서 EL은 RF는 8.835, 10.27, 10.82, 11.24로 나타났다. 결과적으로 가장 낮은 100 ppb 표준시료를 제외한 나머지 표준시료로 도출한 결과값은 거의 일치한다는 것을 확인하였다. R2도 0.9950, 0.9915, 0.9903, 0.9933으로 높은 재현성을 확인하였다. LT/TD방식과 MITD방식 모두에 대한 EL의 RF값을 비교해 보면 평균 10.57 (±0.95)로 나타났다. 이를 고려하면, LT/TD방식과 MITD방식의 검량결과에서 감도의 상대적 차이가 미미한 수준인 것을 확인할 수 있다(그림 3).
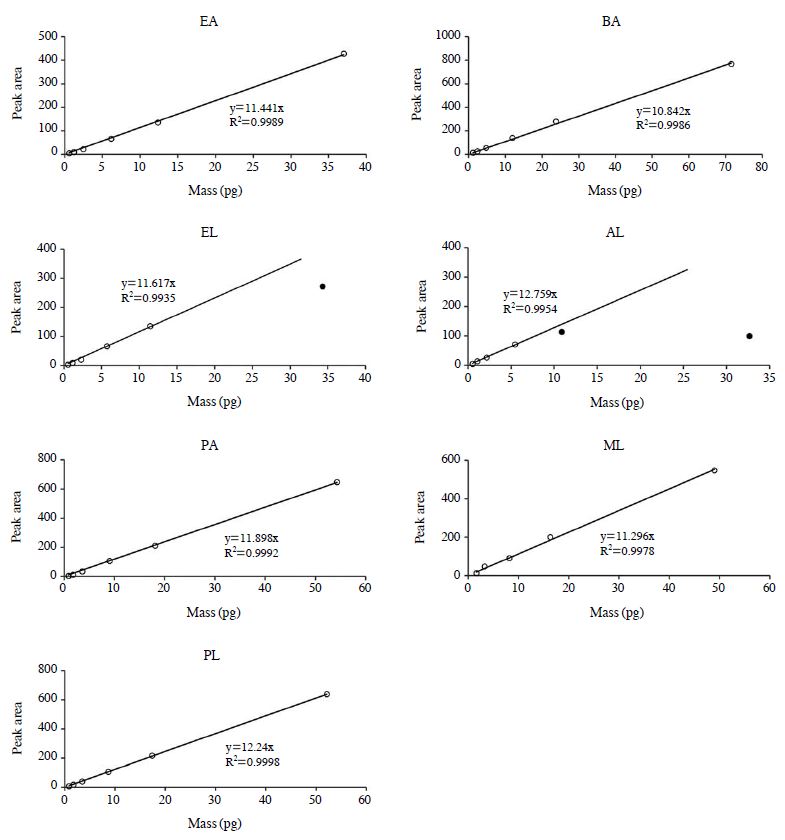
EL과 같이 분석한 LWHC들의 검량결과도 R2가 0.9877~1.0000 수준으로 안정적인 경향을 보였다. 두 가지 분석방법의 RF를 성분 별로 취합하여 함께 비교해보았을 때, 성분 간 그리고 분석방법 간에 상당히 높은 유사성을 확인할 수 있다. 두 가지 방법의 RF값의 평균은 10.28 (±0.86) (EA), 11.24 (±0.80) (PA), 11.94 (±0.63) (PL), 11.06 (±0.42) (BA), 12.73 (±0.92) (AL), 11.52 (±0.49) (ML)으로 나타났다.
LT/TD방식으로 10 ppb의 표준시료를 분석시 시료의 주입부피를 늘려가며 직선성의 한계점(또는 파과 발생여부)를 파악하기 위해 주입 부피를 1,000과 3,000 mL로 추가시험을 진행하였다. 그림 4에 제시한 바와 같이 전체 조사대상 성분 중에서 Ehylene은 3,000 mL (34.3 ng), Acetylene은 1,000 mL (10.9 ng)에서부터 직선성이 벗어나는 경향을 확인하였다. 그리고 Methane은 본 연구의 분석 방식으로 검출할 수 없어 결과값을 제외하였다.
3. 2 환경시료 결과값 분석
본 연구에서 확보한 열탈착분석에 기반을 둔 LT/TD방식을 적용하여 과일과 같은 환경시료를 이용한 분석기법의 실질적인 검정을 시도하였다. 따라서 본 분석방식으로 과일시료에서 발생하는 EL을 포함 총 7가지 LWHC의 발생경향을 분석하였다(표 7). 특히 사과의 경우, 시료의 부위 및 상태변화에 따른 방출 성분의 경향성을 파악하기 위해, 사과 껍질, 사과 알맹이, 부패한 사과의 상태로 세 가지 시료를 준비하였다. 시료에서 방출하는 성분들의 농도는 유량(F), 시료 중 대상성분의 농도(C), 시료의 무게(M) 등을 동시에 고려하여, flux (F)=C∙(Q/M)로 제시하였다 (Kim et al., 2012). 그리고 표 7에는 flux 값의 계산 전 단계에 구한 유속(50 mL∙min-1)로 채취한 시료 중의 농도도 ppb 기준으로 비교할 수 있게 동시에 제시하였다.
EL은 AP-1, A-1, KP-1, T-1에서 20.5 ng∙g-1∙hr-1 이상으로 상대적으로 많은 양이 방출한 것으로 나타났다. 반면, DA-1와 K-1에서는 1.32 ng∙g-1∙hr-1 이하로 적은 양을 방출하였으며, S-1에서는 검출한계 이하로 나타났다. 준비한 시료의 모든 껍질과일에서는 EL이 모두 방출한다는 것을 확인하였다. 그리고 시료 DA-1, KP-1, K-1, T-1에서 추가로 Ethane이 1.81, 1.45, 1.83, 1.25 ng∙g-1∙hr-1으로 방출하였다. 특히 K-1에선 PA, BA, AL, ML들이 각각 0.64, 0.54, 0.14, 3.68 ng∙g-1∙hr-1으로 검출하였다.
사과에서는 AP-1, A-1, DA-1 순으로 EL이 방출하는 것을 확인하였다. 사과의 알맹이보다 껍질에서 많이 방출하였던 것과 유사하다. 부패한 시료의 경우 즉, 노화가 많이 진행한 상태에서는 현저히 낮은 수지 (1.32 ng∙g-1∙hr-1)의 결과로 확인하였다. AP-1, A-1와 DA-1에서 100배 이상의 차이가 나는 것은 사과를 깎을 때 일시적으로 상당히 많은 EL의 방출 가능성을 유추할 수 있다. 본 연구에서 분석할 결과를 단순히 농도 기준으로 비교해 보면, 에틸렌을 제외한 기타 성분들은 환경대기 중에서 나타나는 수준과 유사하다. 참고로 서울 북동 지역에서 1998년 8월부터 1999년 7월까지 환경대기 중에서 채취한 시료를 GCFID방식으로 분석한 결과, 평균 3.8 (EA), 5.9 (EL), 7.8 (PA), 1.8 (PL), 3.4 (BA), 3.4 ppb (AL)으로 나타났다(Na and Kim, 2001). 그러나 에틸렌의 경우 관측이 이루어지는 경우, 일반적인 대기환경보다 상당히 높은 수준이란 것을 알 수 있다. 그리고 다른 연구에서는 GC-FID를 사용하여 단감 100 g에서 1시간 동안 방출한 시료(1 L)를 확보한 결과, 5 ppb 수준의 EL을 검출 하였다(Park and Lee, 2006). 또 다른 과실인 멜론 100g에서 1시간 동안 방출한 시료 1L에 최대 1.3 ppm까지 방출한 것을 GC- FID 방식으로 확인한 바 있다.
4. 결 론
본 연구에서는 에틸렌과 저분자 탄화수소의 분석 기법을 체계적으로 구축하기 위한 노력의 하나로 이들의 표준시료에 대한 GC 주입 전 단계의 전처리 과정 및 열탈착 분석 방법에 대하여 최적의 분석조건을 도출하고자 하였다. 본 연구에서는 LT/TD방식과 MITD방식을 적용하여, 이들 조사대상 성분들을 넓은 범위의 농도대로 비교 분석하였다. 이를 통해, EL 및 저분자 탄화수소성분의 검출한계를 낮은 수치까지 확보하여 미량의 농도 시료로 분석할 수 있는 기술을 제시하고자 하였다. 이러한 분석기법을 사과와 같은 과일 중심의 환경시료에 적용하여, 미량의 EL의 방출 유무 및 강도를 분석하였다.
앞으로도 이들 조사대상 외의 저분자 탄화수소들에도 적용이 가능한 분석기술을 안정적으로 확보하기 위해, 더 많은 연구가 필요한 상황이다. 특히, 시료의 안정적인 보존방식, 분석단계에서 시료의 손실 여부 등과 같이 일반적으로 다양한 VOC성분들로부터 축적한 기술들을 본 연구의 주 대상인 저분자 탄화수소들에까지 확장하여 연구를 진행할 예정이다. 이러한 추가적인 연구를 통해 더욱 안정적인 자료를 확보할 기반을 제공할 수 있을 것이다. 그리고 이러한 분석기술을 환경시료 분석과 같은 연구에 심화 적용 한다면 여러 과일에 대한 신선도 및 부패에 대한 객관적인 참고자료의 확보도 용이하게 할 수 있을 것이다.
Acknowledgments
이 논문은 2013년도 정부(미래창조과학부)의 재원으로 한국연구재단의 기초연구사업 지원을 받아 수행된 것임(과제번호 2013004624).
References
- Abeles, F.B., P. Morgan, M.E. Saltveit, Ethylene in Plant Biology, 2nd edition, Academic Press, San Diego, CA, (1992).
- Kim, K.H., H.O. Yoon, M.C. Jung, J.M. Oh, J.C. Brown, A Simple Approach for Measuring Emission Patterns of Vapor Phase Mercury under Temperature- Controlled Conditions from Soil, Scientific World Journal, (2012), 940413, p8.
-
Kim, Y.H., K.H. Kim, Novel Approach to Test the Relative Recovery of Liquid-Phase Standard in Sorbent- Tube Analysis of Gaseous Volatile Organic Compounds, Anal. Chem, (2012), 84, p4126-4139.
[https://doi.org/10.1021/ac300334b]

- Lim, B.S., Y.M. Park, Y.S. Hwang, G.R. Do, K.H. Kim, Influence of Ethylene and 1-Methylcyclopropene Treatment on the Storage Quality of ‘Hongro’ Apples, HortScience, (2009), 27(4), p607-611.
- Na, K.S., Y.P. Kim, Seasonal characteristics of ambient volatile organic compounds in Seoul, Korea, Atmos. Environ, (2001), 35, p2603-2614.
- Oh, S.Y., B.S. Lim, J.W. Lee, K.R. Do, 1-Methylcyclopropene increases the shelf-life of ‘Ooishiwase’ plums (Prunus salicina L.), HortScience, (2007), 25, p369-374.
- Park, Y.M., Y.J. Lee, Ripening Responses and Quality Changes of ‘Fuyu’ Persimmon Fruit as Influenced by Exogenous Ethylene and Subsequent Shortterm Storage Temperature, Korean. J. Hortic. Sci, (2006), 24, p216-221.