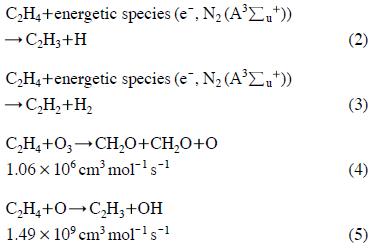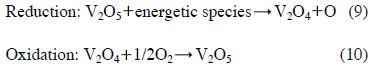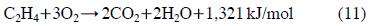Decomposition of Ethylene using a Hybrid Catalyst-packed Bed Plasma Reactor System
Copyright © 2014 Korean Society for Atmospheric Environment
A series of experiments using atmospheric-pressure non-thermal plasma coupled with transition metal catalysts were performed to remove ethylene from agricultural storage facilities. The non-thermal plasma was created by dielectric barrier discharge, which was in direct contact with the catalyst pellets. The transition metals such as Ag and V2O5 were supported on γ-Al2O3. The effect of catalyst type, specific input energy (SIE) and oxygen content on the removal of ethylene was examined to understand the behavior of the hybrid plasma-catalytic reactor system. With the other parameters kept constant, the plasma-catalytic activity for the removal of ethylene was in order of V2O5/γ-Al2O3<Ag/γ-Al2O3<γ-Al2O3 from high to low. Interestingly, the rate of plasma-catalytic ozone generation was in order of V2O5/γ-Al2O3<γ-Al2O3<Ag/γ-Al2O3, implying that the catalyst activation mechanisms by plasma are different for different catalysts. The results obtained by varying the oxygen content indicated that nitrogen-derived reactive species dominated the removal of ethylene under oxygen-lean condition, while ozone and oxygen atoms were mainly involved in the removal under oxygen-rich condition. When the plasma was coupled with V2O5/γ-Al2O3, nearly complete removal of ethylene was achieved at oxygen contents higher than 5% by volume (inlet ethylene: 250 ppm; gas flow rate: 1.0 L min-1; SIE: ~355 J L-1).
Keywords:
Plasma, Catalyst, Ethylene, Transition metal1. 서 론
생활수준의 향상에 따라 사계절 신선한 과일과 야채의 수요가 급증하고 있으며, 이에 따라 신선한 농산물을 공급하기 위한 저장기술 및 장기보관에 대한 기술개발이 요구되고 있다. 농산물의 장기보관에 영향을 미치는 요인으로는 온도, 산소농도, 이산화탄소 농도, 에틸렌농도, 미생물 등이다. 농산물은 저장과정 중에도 수확 전 진행하던 대사과정 및 생리적인 반응을 지속하므로 후숙(after-ripening)과 관련된 품질의 변화가 발생한다(Jang et al., 2012; Saltveit, 1999). 특히, 농산물의 호흡과정에서 발생하는 에틸렌은 종자발아, 성장, 숙성 등 식물의 생장 과정을 제어하는 식물 호르몬으로 작용하며, 일단 생성되면 스스로 합성을 촉진하는 자가 촉매적 특성을 갖고 있어 저장시설 내의 지속적인 에틸렌 농도 증가로 인해 농산물의 상품성이 크게 떨어진다. 에틸렌은 과일, 야채, 화훼작물 등 농산물을 숙성시키는 데 유용하게 이용될 수도 있지만, 아주 낮은 농도(수 ppb~수 ppm)에서도 농작물에 부정적인 영향을 미치므로 장기저장이 필요한 경우에는 반드시 제거되어야 한다(Guo et al., 2014; Ye et al., 2013; Njagi et al., 2012; Zhu and Zhou, 2007; Saltveit, 1999).
에틸렌을 제어할 수 있는 기술에는 에틸렌 합성에 관여하는 각종 효소 및 전구물질을 차단하는 생물학적 방법, 흡착이나 흡수와 같은 물리적 방법, 오존처리, NO 처리, ClO2 처리, 촉매분해, 열소각, 플라즈마 처리 등과 같은 화학적인 방법이 알려져 있다(Guo et al., 2014; Njagi et al., 2012; Zaharah and Singh, 2011; Zhu and Zhou, 2007). 생물학적 방법은 에틸렌 합성을 적절히 조절하기가 매우 까다로우며 비용이 많이 드는 문제점이 있고, 화학적인 방법들은 에틸렌 저감에는 효과적이나 사용되는 화학물질의 농도가 높으면 농작물의 품질이 변화될 수 있고 무해한 수준의 적정한 농도를 유지시키기가 어렵다(Jang et al., 2012; Skog and Chu, 2001). 열소각이나 촉매분해 방식은 에틸렌의 완전한 분해를 위해 가장 효과적인 방법일 수 있지만, 완전연소를 위해 지나치게 많은 에너지가 요구되며 농산물 저장시설의 에틸렌을 제거하는 공정으로는 적절하지 않다(Njagi et al., 2012). 플라즈마 처리 방법은 비교적 새로운 기술로 상압 저온에서 에틸렌을 쉽게 분해시킬 수 있다. 플라즈마 공정에서는 다양한 종류의 산화성 활성 성분들에 의해 에틸렌이 제거된다(Ye et al., 2013). 플라즈마 처리 공정은 응답속도가 빠르고 시스템을 소형화할 수 있는 장점이 있는 반면, 이산화탄소에 대한 선택성이 좋지 않아 유해 부산물을 발생시킬 가능성이 있다. 플라즈마 처리 공정의 장점을 그대로 유지하면서 단점을 극복하기 위한 방법으로 플라즈마와 촉매의 결합에 대한 연구가 활발히 이루어지고 있다.
Kim et al. (2006)은 벤젠 및 톨루엔의 처리에 저온 플라즈마-촉매 시스템을 적용했을 때 촉매의 종류에 따라 CO2 선택도가 큰 차이를 나타낸다고 보고하였으며, Pt/γ-Al2O3를 사용한 경우 CO2 선택도가 97% 가량이었다. Lee et al. (2011)의 황화수소를 대상으로 한 연구에서도 단독 플라즈마 공정보다 촉매-플라즈마 공정이 높은 처리효율을 나타냈다. 또한 Vandenbroucke et al. (2011)에 의하면 촉매 단독 공정은 300~500°C의 온도에서 효과적으로 유입가스의 예열이 필요한 문제점이 있지만, 플라즈마와 촉매를 결합하게 되면 기존 촉매 반응에 비해 훨씬 낮은 온도에서도 유기화합물이 쉽게 분해된다고 하였다. Ye et al. (2013)은 플라즈마와 촉매를 결합했을 때 처리효율이 증가될 뿐만 아니라, 이산화탄소 선택성이 향상되고 촉매 수명이 연장된다고 보고하였다. 즉, 열에 의해 활성화되는 기존의 촉매와 달리 플라즈마-촉매 반응은 실온 또는 촉매 활성화에 필요한 온도보다 낮은 온도에서도 유기화합물을 쉽게 분해할 수 있는 효과적인 방법이다(Jo et al., 2013; Demidiouk and Chae, 2005). Ag 촉매는 오존 분해 및 에틸렌의 산화반응에 이용되며, 높은 온도를 필요로 하지 않는 경우에는 높은 활성과 내구성을 나타내어 저온에서 분해 가능한 유기화합물의 처리에 효과적이다(Tang et al., 2006; Imamura et al., 1994). Shi et al. (2012)은 폼알데하이드(formaldehyde) 제거에 Ag/HZSM-5와 Ag-MnOx- CeO2를 사용한 바 있으며, Ag가 실내 폼알데하이드 제거를 위한 유망한 촉매라고 보고하였다. 한편, 바나듐(vanadium) 촉매는 염소와 황화합물에 저항성이 강하여 환경촉매로 많이 사용된다. Ding et al. (2014)은 바나듐을 기본으로 하는 여러 종류의 촉매를 제조하여 프로페인(propane) 제거에 사용하였으며, Gannoun et al. (2014)은 V2O5/TiO2를 이용하여 클로로벤젠(chlorobenzene)의 산화특성을 평가하였다.
본 연구에서는 에틸렌 분해를 위해 γ-Al2O3에 담지된 전이금속 촉매(Ag, V2O5)를 플라즈마와 결합하여 사용하였다. 플라즈마 발생 방식으로는 유전체장벽방전(dielectric barrier discharge)을 사용하였다. 플라즈마 방전 공간 내에 촉매를 충진한 반응기 구조에서는 촉매가 직접 플라즈마에 노출되므로 수명이 짧은 활성성분들도 촉매를 활성화하는 데 기여할 수 있다. 촉매 종류, 산소농도 및 에너지밀도가 에틸렌의 분해에 미치는 영향을 조사하였다.
2. 실 험
2. 1 촉매 제조
본 연구에 사용된 촉매지지체는 길이 3.2~3.5 mm, 지름 3.2mm인 원통형 모양의 γ-Al2O3 (Alfa Aesar, USA)였다. 알루미나는 촉매 분야에서 가장 널리 사용되는 지지체 중 하나로써 비표면적이 넓고 안정한 결정상을 이루고 있다(Martinez-Huerta et al., 2006). Ag/γ-Al2O3 촉매는 Ag 함량이 2 wt%가 되도록 질산은 (AgNO3, Sigma-Aldrich, USA)을 증류수에 용해한 후 γ-Al2O3에 함침시켜 제조하였으며, V2O5/γ-Al2O3 촉매는 V 함량이 2 wt%가 되도록 ammonium vanadate (V) (NH4VO3, Junsei, Japan)를 중류수에 용해한 후 γ-Al2O3에 함침시켜 제조하였다. Ag 또는 V가 함침된 γ-Al2O3는 100°C에서 24 h의 건조 과정을 거친 후 550°C에서 6h 동안 소성시켰다.
그림 1은 γ-Al2O3, Ag/γ-Al2O3, V2O5/γ-Al2O3 촉매를 전계방출주사전자현미경(FE-SEM, JEOL JSM-6700F, Japan)으로 10,000배 확대하여 촬영한 것이다. 그림 1에서 보는 바와 같이 γ-Al2O3는 표면이 다소 매끄러운 반면, Ag/γ-Al2O3에서는 Ag가 γ-Al2O3표면에 약 10~100 nm의 크기로, V2O5/γ-Al2O3에서는 V2O5가 약 0.1~1 μm 크기로 고르게 분포되어 있는 것을 볼 수 있다. 비표면적 분석기(Surface Area & Pore Size Analyzer, Autosorb-1-mp, USA)를 이용하여 Brunauer-Emmett-Teller (BET) 비표면적을 측정한 결과 γ-Al2O3는 175m2 g-1, Ag/γ-Al2O3는 185m2 g-1, V2O5/γ-Al2O3는 183m2 g-1로 촉매 담지 전∙후에 비표면적이 크게 차이 나지 않았다.
2. 2 실험 장치 및 방법
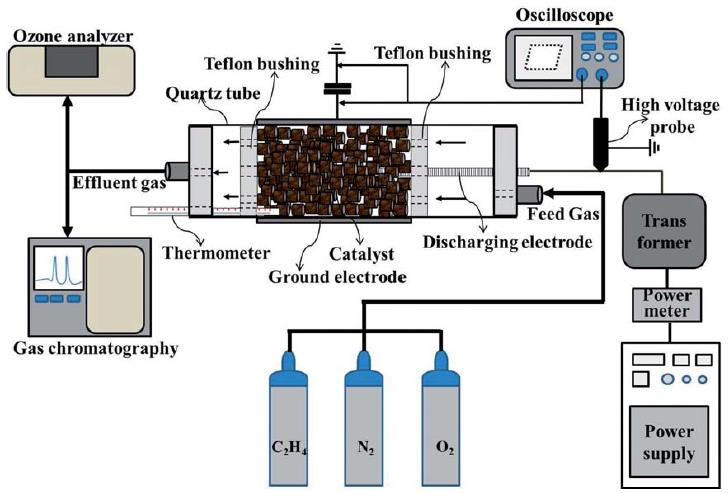
에틸렌 분해를 위한 플라즈마-촉매 반응기는 그림 2와 같다. 플라즈마-촉매 반응기는 석영관(내경: 26mm; 외경: 30mm)으로 이루어져 있으며, 석영관 외부는 접지전극 역할을 하는 알루미늄 박막이 코팅되어 있다. 석영관의 중심에는 고전압이 인가되는 고전압 방전전극(직경: 6 mm; 재질: 스테인리스 스틸)이 동축으로 삽입되었다. 알루미늄 접지전극의 길이는 130 mm가 되도록 하였으며, 접지전극이 설치된 영역에서 유전체장벽방전 플라즈마가 발생된다. 석영관 내부의 플라즈마 발생영역에 촉매를 30 g 충진하였다. 방전전극에는 60 Hz의 교류 고전압을 인가하였는데 인가된 고전압은 19.2 kV~28.8 kV로 변화시키며 실험을 수행하였다. 반응기 양쪽에 기체 유입구와 유출구를 설치하였다. 유입구에는 산소, 질소, 에틸렌 혼합 기체가 유입되며, 기체의 총 유입 유량은 유량조절기(AFC 500, Atovac, Korea)를 이용하여 전체유량이 1.0 L min-1이 되도록 조절하였다.
유입기체의 에틸렌 농도는 250 ppm으로 고정하였으며, 산소농도는 0~20%로 가변하며 실험을 수행하였다. 플라즈마-촉매 반응을 거친 기체는 기체크로마토그래프(GC, Bruker 450, Germany)와 오존 분석기(Porta Sens II, Analytical Technology, Inc., USA)를 이용하여 분석하였다. 기체크로마토그래프의 검출기는 불꽃이온화검출기(FID), 컬럼은 BR-624 ms (60 m, 0.32 mm, 1.80 μm, Bruker, USA)였으며, 오븐조건은 초기온도 50°C에서 9 min 후 60°C(온도상승 속도: 1.11°C min-1)로 설정하였다. 플라즈마 방전에 의해 촉매반응기의 온도가 증가되므로 알코올온도계를 반응기 내에 설치하여 플라즈마 방전에 따른 온도 변화를 관찰하였다.
플라즈마-촉매 반응기에서 소모되는 전력(방전전력)은 전압-전하 선도를 이용하여 측정하였다(Jo et al., 2013). 전압 측정에는 오실로스코프(TDS 3032, Tektronix)와 1000 : 1 고전압 프로브(P6015, Tektronix)가 사용되었고, 반응기에 직렬로 연결된 축전기(1.0 μF) 양단의 전압을 10 : 1 전압 프로브(P6139A, Tektronix)로 측정함으로써 전하를 구하였다. 에너지밀도(specific input energy, SIE)는 다음과 같이 정의된다(Jarrige and Vervisch, 2009):
여기서 P는 방전전력(W)이고 Q는 기체유량(L s-1)이다.
3. 결과 및 고찰
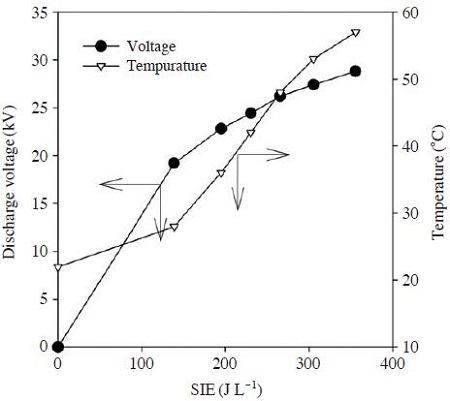
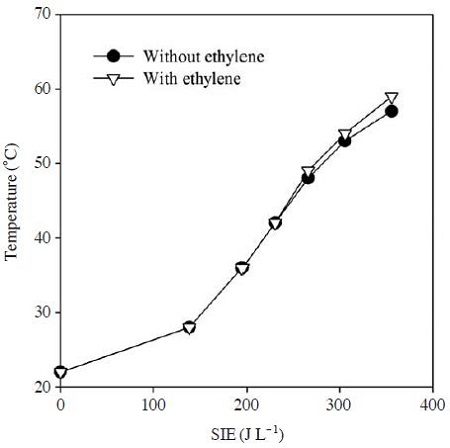
그림 3은 에너지밀도 변화에 따른 플라즈마-촉매반응기 내부의 온도변화를 나타낸 것이다. 플라즈마-촉매 반응기에는 γ-Al2O3가 충진 되었으며, 반응기 운전이 시작된 후 약 10 min이 경과한 다음 온도를 측정하였다. 전압을 증가시키면 전기장세기가 강해져 기체가 더 쉽게 이온화되므로 방전전류가 증가하게 된다. 따라서 전압의 증가에 따라 방전전력이 커지며, 식 (1)과 같이 에너지밀도가 변화된다. 그림에서 보는 바와 같이 에너지 밀도가 약 140 J L-1일 때 방전전압은 19.2 kV (피크치)이며, 이때 반응기 내부의 온도는 28°C였다. 전압을 높여 에너지 밀도를 더욱 증가시키면 이에 비례하여 반응기 온도가 증가되었는데 에너지 밀도가 약 355 JL-1일 때 방전전압과 반응기 내부 온도는 각각 28.8 kV와 57°C로 나타났다. 플라즈마-촉매 반응기는 전기적으로 일종의 부하로 취급할 수 있으므로, 반응기에 투입되는 에너지가 증가할수록 당연히 발생하는 열도 증가하게 되므로 온도가 상승한다. 그러나 플라즈마-촉매 반응기가 단열되지 않아 실험 범위에서 60°C 이상으로 온도가 증가하지는 않았다.
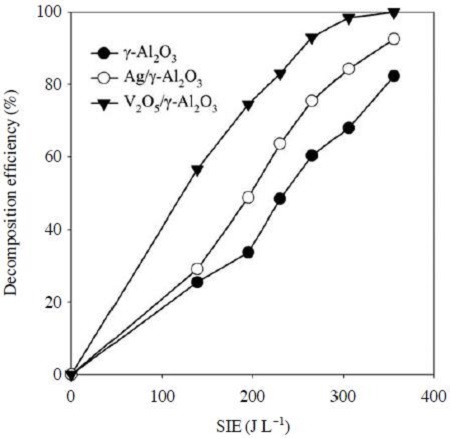
그림 4에는 에너지밀도 변화에 따른 에틸렌 분해 효율을 나타내었다. 그림에서 보는 바와 같이 동일한 에너지밀도에서 비교하면 V2O5/γ-Al2O3 촉매가 에틸렌 분해 효율이 가장 좋았으며, γ-Al2O3 촉매가 가장 낮은 효율을 나타냈다. V2O5/γ-Al2O3 촉매를 사용한 경우 300 J L-1의 에너지밀도에서 99%의 에틸렌 분해 효율을 나타냈으며, Ag/γ-Al2O3의 경우 84%, γ-Al2O3를 사용한 경우 67%의 효율을 보였다. 에틸렌의 분해 속도는 플라즈마-촉매 반응에서 생성되는 활성성분(라디칼, 오존, 여기된 분자, 전자)과 에틸렌과의 반응에 의해 결정된다. 플라즈마 반응에서 에틸렌의 1차적인 분해 반응은 다음과 같다(Jo et al., 2013).
위에서 e-는 전자를 의미하고 반응속도상수는 298 K에서의 값이다. 전자와 에틸렌의 반응속도는 전자에너지분포와 밀접한 관련이 있으며, 전자에너지분포는 전기장세기에 의해 결정된다. 식(4)에 제시된 에틸렌과 오존의 반응은 속도상수 자체는 식(5)에 비해 작으나 오존의 수명이 산소 라디칼에 비해 길기 때문에 에틸렌의 반응에 중요한 역할을 할 수 있다. 식(2)~(5)에 의해 생성된 C2H3, C2H2, CH2O는 더욱 산화되어 결국 이산화탄소로 전환된다.
플라즈마에 의한 촉매의 활성화는 여러 가지 메커니즘에 의해 일어날 수 있다. 수명이 짧은 활성성분들이 촉매 표면에 흡착하게 되면 유효 수명이 길어지므로 더 많은 활성성분들이 에틸렌 분해반응에 참여할 수 있다. 또한 오존 자체보다는 오존에서 생성된 산소 라디칼의 반응성이 더 높으므로 촉매 표면에서 오존이 분해되어 산소 라디칼이 생성되면, 오존이 기체상에 존재할 때보다 더욱 빠르게 에틸렌을 분해할 수 있다. 그 밖에 에틸렌이 촉매표면에 흡착되어 고정되면, 플라즈마 상태에서 생성된 활성성분들과의 충돌빈도가 높아질 수 있으므로 반응이 더 효과적으로 일어나게 된다.
그림 5는 그림 4와 동일한 실험조건에서 플라즈마-촉매 반응기에 공기가 주입되었을 때와 에틸렌 혼합기체(질소: 80%; 산소: 20%; 에틸렌: 250 ppm)가 주입되었을 때의 반응기 후단 오존농도를 비교한 결과이다. 촉매로 γ-Al2O3를 사용한 경우에 에너지밀도 355JL-1에서 100 ppm의 오존이 생성되었으며, 에틸렌을 주입한 경우 40 ppm으로 낮아져 에틸렌을 분해하는 과정에서 60ppm의 오존이 소비되었다고 할 수 있다. Ag/γ-Al2O3 촉매를 사용하고 공기를 주입한 경우에는 55 ppm의 오존이 생성되었고, 에틸렌 주입 후에는 40 ppm으로 감소하였다. Ag는 오존 분해 촉매로 알려져 있으며(Naydenov et al., 2008), 플라즈마에 의해 생성된 오존이 Ag/γ-Al2O3 촉매상에서 분해되어 Ag/γ-Al2O3를 사용한 경우에 비해 오존 농도가 감소한 것으로 판단된다. 오존은 촉매에 의해 아래와 같은 반응에 의해 분해될 수 있다(Yin et al., 2009):
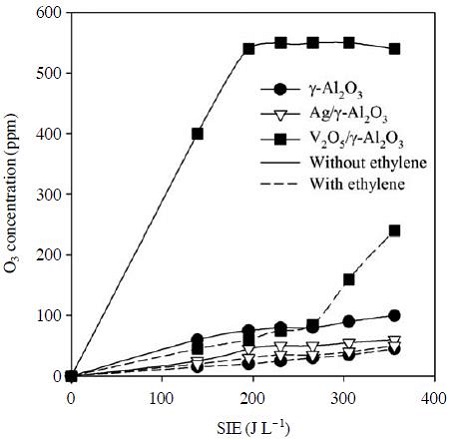
Ozone concentrations at the outlet of the hybrid plasma-catalytic reactor in the presence and in the absence of ethylene (O2: 20%).
여기서 *는 촉매표면의 활성점을 나타내며, O*는 활성점에 흡착된 상태의 산소원자를 의미한다. 그림 4에서 Ag/γ-Al2O3 촉매를 사용한 경우 γ-Al2O3에서 보다 에틸렌 분해효율이 증가한 것은 오존분해 과정에서 생성된 O*에 의한 영향으로 해석할 수 있다. V2O5/γ-Al2O3 촉매를 사용한 경우 전이금속이 담지되지 않은 γ-Al2O3 경우에 비해 오존 생성량이 크게 증가하였다. 그림 5와 같이 V2O5/γ-Al2O3 촉매를 사용했을 때 195 J L-1 이상의 에너지밀도에서 약 540 ppm의 오존이 생성되었다. 하지만 250 ppm의 에틸렌을 주입하면 270 J L-1 이상에서 오존농도가 급격히 증가하여 355 J L-1에서는 240 ppm의 오존이 배출되었다. 에틸렌이 주입되었을 때 에너지밀도 270 J L-1 이상에서 오존 농도가 갑자기 증가하는 이유는 그림 4와 연관하여 해석할 수 있다. 그림 4와 같이 V2O5/γ-Al2O3 촉매를 사용했을 때 270 JL-1의 에너지밀도에서 대부분의 에틸렌이 분해된다. 즉, 기체상에 에틸렌이 다량 존재할 경우에는 생성되는 오존이 에틸렌과 반응하므로 배출되는 오존의 양이 적으나, 에틸렌이 모두 분해되고 나면 더 이상 반응할 대상이 없으므로 배출되는 오존농도가 증가하게 된다. V2O5/γ-Al2O3 촉매를 사용한 경우 Ag/γ-Al2O3 촉매에 비해 10배 가량 더 많은 오존이 생성되었지만, V2O5/γ-Al2O3 촉매에 의한 에틸렌 분해효율 증가 폭은 그다지 크지 않았다. 이 결과는 오존 이외에도 다른 활성성분들이 에틸렌의 분해 반응에 참여하였고, 에틸렌의 분해가 다양한 경로에 의해 일어났음을 의미한다. 한편, V2O5 촉매를 사용했을 때 오존 생성농도가 증가한 이유는 플라즈마에 의한 촉매의 산화-환원과정으로 해석된다:
식(9)에서 생성된 산소 라디칼은 산소분자와 반응하여 오존을 생성할 수 있다.
일반적으로 유기화합물이 분해되면 발열반응에 의해 반응기 내부의 온도가 상승한다. 총괄 반응 관점에서 에틸렌의 산화반응은 다음과 같이 표현될 수 있다:
그림 6은 플라즈마-촉매 반응기에 공기가 주입되었을 때와 에틸렌 혼합기체(질소: 80%; 산소: 20%; 에틸렌: 250 ppm)가 주입되었을 때의 반응기 온도를 에너지밀도의 함수로 비교한 결과이다. 반응기에는 γ-Al2O3가 충진되었으며 반응기 운전 10 min 후에 온도가 측정되었다. 그림에서 보는 바와 같이 에너지밀도 350 J L-1에서 약 2°C의 온도차가 발생하였다. 에틸렌의 유무에 따라 온도차가 크지 않은 이유는 농도가 250 ppm으로 매우 낮았고 반응기가 자연 냉각되었기 때문이다. 에너지 밀도 355 JL-1에서 에틸렌 분해효율이 83%이므로 기체 1L당 11.2 J의 연소열이 가해져 반응기 온도가 약 9°C 가량 더 증가할 것으로 예상되었으나 반응기가 단열되지 않은 상태였으므로 온도증가가 이보다 낮았다.
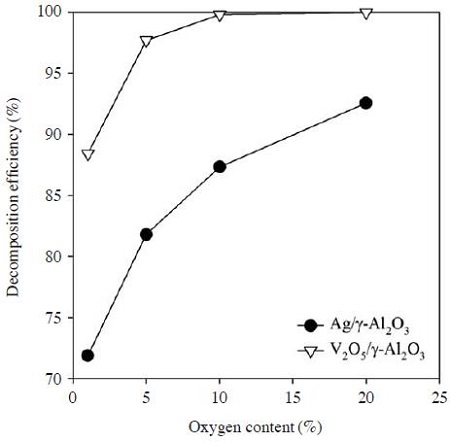
그림 7은 Ag/γ-Al2O3와 V2O5/γ-Al2O3 촉매의 에틸렌 분해효율을 산소농도의 함수로 측정한 결과이다. 모든 조건은 동일한 상태로 유지하면서 산소농도를 1~20%로 변화시키며 실험을 수행하였다. 산소가 없는 분위기에서는 고에너지전자, 질소원자, 여기 상태의 질소분자가 주로 에틸렌의 분해에 관여하지만, 산소가 존재하면 오존, 산소 라디칼 등의 산화성 활성성분들이 추가적으로 생성된다. 그림 7에서 보는 바와 같이 V2O5/γ-Al2O3 촉매를 사용한 경우에는 산소농도가 5%를 넘으면 대부분의 에틸렌이 분해되었고, Ag/γ-Al2O3 촉매를 사용한 경우에도 산소농도가 높아질수록 에틸렌 분해효율이 증가하였다. Ag/γ-Al2O3 촉매에서 산소농도가 20%일 때의 에틸렌 분해효율은 약 93%로 산소농도 1%일 때의 72%와 비교하면 약 20% 가량의 차이를 보였다. 산소농도가 1%에 불과해도 72%의 에틸렌 분해효율이 나타나는 것은 산소에 기인한 활성성분들 이외에도 질소에 기인한 활성성분들 및 고에너지 전자에 의해 에틸렌이 분해되기 때문이다. V2O5/γ-Al2O3 촉매를 사용한 경우에는 산소농도 5% 이상에서 에틸렌을 분해하는 데 충분한 활성산화종이 생성되는 것으로 판단된다.
그림 8은 그림 7과 같은 조건에서 산소농도에 따른 배출 오존 농도를 측정한 결과이다. 그림에서 보는 바와 같이 산소농도 1%에서는 Ag/γ-Al2O3와 V2O5/γ-Al2O3 촉매를 사용한 경우 모두 배출 오존이 발생하지 않지만, V2O5/γ-Al2O3 촉매를 사용한 경우에는 산소농도가 증가할수록 배출 오존 농도가 급격하게 증가하여 산소농도 20%에서는 240 ppm의 오존이 배출되었다. 이와 같은 이유는 앞에서 언급한 바와 같이 에틸렌을 분해하는 데 충분한 활성산화종이 생성되어 반응에 소모되지 않은 오존이 그대로 배출되는 것으로 판단된다. 선행연구에서(Jo et al., 2013) 이산화망간 촉매에 의해 배출 오존이 효과적으로 제어됨을 확인한 바 있으며, 본 연구의 플라즈마-촉매 반응기 후단에 오존 제어를 위한 촉매반응기가 도입될 수 있다.
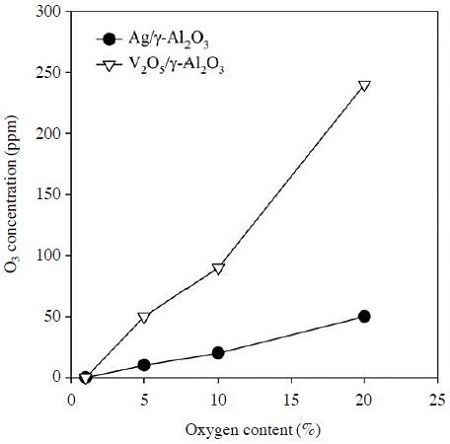
Ozone concentrations at the outlet of the hybrid plasma-catalytic reactor as a function of oxygen content (SIE: 355 J L-1).
플라즈마-촉매 기술은 농산물 저장시설에서 문제가 되고 있는 에틸렌 저감에 효과적인 방법으로 사료된다. 농산물 저장시설은 규모가 매우 다양하며, 저장시설 공간의 대부분은 농산물로 채워져 있고 기체가 차지하는 공간은 20% 미만이다. 예를 들어, 5×5×4m3(=100m3) 저장시설에서 기체가 차지하는 부피는 20m3 미만이다. 20m3의 기체를 2 h 동안 처리한다고 가정하면, 처리속도가 170 L min-1는 되어야 한다. 플라즈마-촉매 공정의 장점 중 하나는 스케일업(scale-up)이 용이하다는 점이다. 반응기의 길이를 증가시키면 처리용량이 증가되고, 반응기 개수를 병렬로 늘려도 처리용량이 증가되므로, 처리대상의 부피를 고려한 격상 설계가 용이하게 이루어질 수 있다. 또한 실제 현장에 적용하기 위해서는 저장 농산물의 종류에 따른 에틸렌 농도 특성 및 저장시설 내부의 환경 변화 등을 고려하여야 한다.
4. 결 론
본 연구에서는 γ-Al2O3에 담지된 전이금속 촉매와 유전체장벽방전을 결합한 플라즈마-촉매 반응기 시스템에서 에틸렌 저감 특성에 대해 조사하였다. 에너지밀도를 변화시켜 에틸렌 제거효율을 측정한 결과 V2O5/γ-Al2O3 촉매를 사용한 경우 355 J L-1에서 에틸렌 분해효율이 100%로 나타났으며, Ag/γ-Al2O3 촉매를 사용한 경우에는 동일한 에너지밀도에서 92.5%, γ-Al2O3 촉매를 사용한 경우에는 82%로 V2O5/γ-Al2O3<Ag/γ-Al2O3<γ-Al2O3 순으로 플라즈마-촉매활성이 높게 나타났다. V2O5/γ-Al2O3 촉매는 에틸렌 제거효율이 높은 반면, 배출 오존 농도도 높은 것으로 나타났다. V2O5/γ-Al2O3 촉매를 사용했을 때 산소농도 5% 이상에서 대부분의 에틸렌이 제거되었다. 실험결과를 종합해보면 에틸렌 분해에 V2O5/γ-Al2O3 촉매가 가장 우수하였으나, 배출 오존 농도 제어를 위해서는 배출 오존 제어 촉매의 도입이 필요하다. 에틸렌 분해에 미치는 산소함량의 영향을 살펴보면, 산소함량에 따라 에틸렌 분해에 관여하는 주 활성성분이 다른 것으로 판단된다. 본 연구의 실험조건에서 플라즈마 방전 후에도 반응기 온도가 60°C를 넘지 않았는데, 이 결과는 플라즈마에 의한 촉매 활성화가 열보다는 산소 라디칼, 오존 등 활성성분에 의해 일어난다는 것을 의미한다.
Acknowledgments
이 논문은 2014학년도 제주대학교 학술진흥연구비지원사업에 의하여 수행되었음.
References
-
Demidiouk, V., and J.O. Chae, (2005), Decomposition of Volatile Organic Compounds in Plasma-Catalytic System, IEEE Trans. Plasma Sci, 33, p157-161.
[https://doi.org/10.1109/TPS.2004.841621]

-
Ding, D., Y. Zheng, H. Li, Z. Tang, M. Chen, and H. Wan, (2014), Model catalysis studies of the oxidation of propane over VOx-based catalysts, Catal. Today.
[https://doi.org/10.1016/j.cattod.2014.05.005]

-
Gannoun, C., A. Turki, H. Kochkar, R. Delaigle, P. Eloy, A. Ghorbel, and E.M. Gaigneaux, (2014), Elaboration and characterization of sulfated and unsulfated V2O5/TiO2 nanotubes catalysts for chlorobenzene total oxidation, Appl. Catal. B, 147, p58-64.
[https://doi.org/10.1016/j.apcatb.2013.08.009]

-
Guo, Q., B. Wu, X. Peng, J. Wang, Q. Li, J. Jin, and Y. Ha, (2014), Effects of chlorine dioxide treatment on respiration rate and ethylene synthesis of postharvest tomato fruit, Postharvest Biol. Technol, 93, p9-14.
[https://doi.org/10.1016/j.postharvbio.2014.01.013]

-
Imamura, S., D. Uchihori, and K. Utani, (1994), Oxidative decomposition of formaldehyde on silver-cerium composite oxide catalyst, Catal. Lett, 24, p377-384.
[https://doi.org/10.1007/BF00811810]

- Jang, D.I., T.H. Lim, S.B. Lee, Y.S. Mok, and H.M. Park, (2012), Decomposition of ethylene by using dielectric barrier discharge plasma, Appl. Chem. Eng, 23(6), p608-613.
-
Jarrige, J., and P. Vervisch, (2009), Plasma-enhanced catalysis of propane and isopropyl alcohol at ambient temperature on a MnO2-based catalyst, Appl. Catal. B, 90, p74-82.
[https://doi.org/10.1016/j.apcatb.2009.02.015]

-
Jo, J.O., S.B. Lee, D.L. Jang, and Y.S. Mok, (2013), Plasma-catalytic ceramic membrane reactor for volatile organic compound control, IEEE Trans. Plasma Sci, 41, p3021-3029.
[https://doi.org/10.1109/TPS.2013.2279551]

- Kim, H.H., A. Ogata, and S. Futamura, (2006), Nonthermal plasma-driven catalysis of benzene and toluene, J. Korean Soc. Atmos. Environ, 22, p43-51.
- Martinez-Huerta, M.V., X. Gao, H. Tian, I.E. Wachs, J.L.G. Fierro, and M.A. Bañares, (2006), Oxidative dehydrogenation of ethane to ethylene over aluminasupported vanadium oxide catalysts: Relationship between molecular structures and chemical reactivity, Catal. Today, 118, p279-287.
-
Naydenov, A., P. Konova, P. Nikolov, F. Klingstedt, N. Kumar, D. Kovacheva, P. Stefanov, R. Stoyanova, and D. Mehandjiev, (2008), Decomposition of ozone on Ag/SiO2 catalyst for abatement of waste gases emissions, Catal. Today, 137, p471-474.
[https://doi.org/10.1016/j.cattod.2007.11.020]

-
Njagi, E.C., H.C. Genuino, C.K. King’ondu, S. Dharmarathna, and S.L. Suib, (2012), Catalytic oxidation of ethylene at low temperatures using porous copper manganese oxides, Appl. Catal. A, 421-422, 154-160.
[https://doi.org/10.1016/j.apcata.2012.02.011]

-
Lee, J.K., H.G. Kim, C.K. Bong, S.J. Park, M.H. Lee, U.H. Hwang, and J.H. Kim, (2011), Characteristics of hydrogen sulfide removal by a catalyst-assisted plasma system, J. Korean Soc. Atmos. Environ, 27, p379-386.
[https://doi.org/10.5572/KOSAE.2011.27.4.379]

-
Saltveit, M.E., (1999), Effect of ethylene on quality of fresh fruits and vegetables, Postharvest Biol. Technol, 15, p279-292.
[https://doi.org/10.1016/S0925-5214(98)00091-X]

- Shi, C., B.B. Chen, X.S. Li, M. Crocker, Y. Wang, and A.M. Zhu, (2012), Catalytic formaldehyde removal by “storage-oxidation” cycling process over supported silver catalysts, Chem. Eng. J, 200-202, 729-737.
- Skog, L.J., and C.L. Chu, (2001), Effect of ozone on qualities of fruits and vegetables in cold storage, Can. J. Plant Sci, 81(4), p773-778.
-
Tang, X., J. Chen, Y. Li, Y. Li, Y. Xu, and W. Shen, (2006), Complete oxidation of formaldehyde over Ag/MnOx-CeO2 catalysts, Chem. Eng. J, 118, p119-125.
[https://doi.org/10.1016/j.cej.2006.02.002]

-
Vandenbroucke, A.M., R. Morent, N.D. Geyter, and C. Leys, (2011), Non-thermal plasmas for non-catalytic and catalytic VOC abatement, J. Hazard. Mater, 195, p30-54.
[https://doi.org/10.1016/j.jhazmat.2011.08.060]

- Ye, S.Y., Y.C. Fang, X.L. Song, S.C. Luo, and L.M. Ye, (2013), Decomposition of ethylene in cold storage by plasma-assisted photocatalyst process with TiO2/ACFbased photocatalyst prepared by gamma irradiation, Chem. Eng. J, 225, p499-508.
-
Yin, Y., Y. Zheng, S. He, and Q. Cui, (2009), Decomposion of indoor ozone on activated carbon-supported catalysts, The 3rd International Conference on Bioinformatics and Biomedical Engineering.
[https://doi.org/10.1109/ICBBE.2009.5162574]

- Zaharah, S.S., and Z. Singh, (2011), Mode of action of nitric oxide in inhibiting ethylene biosynthesis and fruit softening during ripening and cool storage of ‘Kensington Pride’ mango, Postharvest Biol. Technol, 62, p258-266.
-
Zhu, S.H., and J. Zhou, (2007), Effect of nitric oxide on ethylene production in strawberry fruit during storage, Food Chemistry, 100, p1517-1522.
[https://doi.org/10.1016/j.foodchem.2005.12.022]